Кукурузный мотылек Ostrinia nubilalis (Hbn.) — один из наиболее опасных вредителей кукурузы Zea mays L. Самки откладывают яйца в виде кладок, похожих на капельки стеарина. Гусеницы большую часть времени питаются скрытно, проделывая ходы внутри растений, чаще стеблей, однако повреждают все надземные части, включая листья, метелку, початок (рис. 1). В центральной части России развивается одно поколение вредителя в году, на Северном Кавказе — два, причем вредоносность первого поколения обычно существенно выше, чем второго, несмотря на то, что численность насекомых, как правило, значительно ниже. Вредоносность кукурузного (стеблевого) мотылька зависит от фазы развития растения, во время которой происходит питание. Наиболее вредоносны повреждения стебля до, во время и сразу после выметывания метелки. Чем ближе к созреванию, тем слабее повреждение влияет на продуктивность растения. Вредоносность кукурузного (стеблевого) мотылька зависит от условий произрастания, скороспелости и сортовой устойчивости растений. Особенности биологии вредителя и меры борьбы с ним в Краснодарском крае описаны в ранее опубликованной на нашем сайте статье. Использование генетически модифицированных форм кукурузы, несущих продуцирующие токсины гены Bt, стало общепринятым приемом борьбы с вредителем сначала в США, а затем и во многих странах мира (Barry et al., 2000; Walker et al., 2000; Burkness et al., 2001; Baute et al., 2002; Pilcher et al., 2002; Catangui, 2003; Willmot et al., 2004; Wilson et al., 2005). Благодаря внедрению ГМО средняя урожайность кукурузы в США выросла примерно на 15 ц/га (Troyer, 2009). Конечно, интерес к природной устойчивости кукурузы к вредителю и в этой стране окончательно не угас (Labatte et al., 1997; Abel et al., 2000; Bohn et al., 2003), ибо природные источники характеризуются определенными преимуществами. Нынешняя ситуация в России напоминает печально знаменитую позицию Л.Д. Троцкого на переговорах с немцами в конце Первой мировой войны: «ни мира, ни войны, а армию распустить», ибо с одной стороны трансгенные культуры не разрешены для выращивания отечественному производителю (даже научно-исследовательская работа с ними крайне затруднена), а импортные товары, в изобилии содержащие генетически-модифицированную продукцию, свободно проникают на российский рынок. Так или иначе, селекционная работа с кукурузой, направленная на усиление ее природной устойчивости к кукурузному (стеблевому) мотыльку, сохраняет свою актуальность, тем более в нынешних условиях нашей страны. Впервые образец кукурузы с природной устойчивостью к кукурузному (стеблевому) мотыльку — местный аргентинский сорт Maiz Amargo — был обнаружен в конце 20-х годов прошлого века (Marston, 1933). В дальнейшем нашлось еще немало генотипов, проявляющих устойчивость к кукурузному (стеблевому) мотыльку (Шмараев, 1975; Вилкова и др., 1988; Фролов, Чумаков, 1990; Guthrie, Dicke, 1972; Hudon et al., 1979; Hudon, Chiang, 1985 и др.). Методические приемы изучения и выделения устойчивых форм кукурузы разрабатывали также и в нашей стране, начиная с конца 50-х годов прошлого века (Шапиро и др., 1971, 1980; Вилкова и др., 1989). У насекомых, питающихся на устойчивых растениях, обнаруживается прямой токсический (особенно в отношении гусениц I-II возрастов), антиметаболический, детеррентный, антифидантный и другие эффекты, снижается репродуктивный потенциал, и в конечном счете — численность популяции (Шапиро и др., 1979, 1980; Переверзев, 1986; Иващенко, 1988; Penny, Dicke, 1959; Chiang, Holdaway, 1960; Guthrie et al., 1960; Reed et al., 1972; Niemeyer et al., 1987 и др.). Благодаря селекционной работе, особенно активно проводившейся в США, уровень устойчивости гибридов непрерывно рос (Сhiang, 1968; Windels et al., 1974). Эти работы усилились с конца прошлого – начала нынешнего века, как в Европе, так и в Китае (Coppolino, 1979; Zhou et al., 1987). В иммунологической системе кукурузы, как и других растений, выделяют барьеры, обуславливающие антиксеноз, антибиоз и выносливость к повреждениям (Пайнтер, 1953). Больше всего информации накоплено по антибиотической устойчивости кукурузы к вредителю, что связано с высокой ее эффективностью, простотой идентификации и относительной легкостью практического использования. Максимальная смертность гусениц кукурузного (стеблевого) мотылька отмечается в I-II возрастах в течение нескольких дней после начала питания (Huber, 1936; Patch, 1943; Chiang, Holdaway, 1960; Dharmalingam et al., 1984; Buske, Witkowski, 1985; Robinson et al., 1978). В этот период происходят активные миграции гусениц, более интенсивные при неблагоприятности мест питания (Neiswander, Savage, 1931; Chiang, Hodson, 1959; Robinson et al., 1978; Hudon, LeRoux, 1986). Различия в поврежденности растений разных генотипов главным образом связаны с дифференциальной выживаемостью насекомых в этот период их развития (Chiang, Holdaway, 1960; Guthrie et al., 1960; Guthrie, 1971; Buske, Witkowski, 1985; Hudon, LeRoux, 1986 и др.). На устойчивых сортах смертность гусениц достигает 95% и более, снижается скорость развития насекомых, ухудшается их физиологическое состояние (Шапиро и др., 1979a; Chiang, Holdaway, 1960; Penny, Dicke, 1959; Guthrie et al., 1960). Места питания гусениц I-II возрастов меняются в зависимости от фазы развития растений. Так, питание гусениц первого поколения обычно начинается внутри свернутых спиралью этиолированных частей листьев воронки (Beck, 1956); гусеницы второго поколения питаются пыльцой, скопившейся в основании листьев, тканями влагалищ и воротничков листьев, листовыми обвертками початка и пестичными нитями (Beck, 1956a; Guthrie et al., 1970, 1989). Смертность гусениц зависит от фазы развития растений: она минимальна в период цветения (Neiswander, Huber, 1929; Patch, 1942; Luckmann, Decker, 1952). Как показывает мировой опыт, с наибольшей частотой устойчивость к кукурузному (стеблевому) мотыльку обнаруживается у растений до цветения (в фазу листовой воронки) (Guthrie et al., 1960; Guthrie, Dicke, 1972; Hudon, Chiang, 1985 и др.), тогда как позднее она весьма редка (Pesho et al., 1965; Barry et al., 1983; Barry, 1989; Guthrie, 1989; Mihm, 1985) и известен лишь один источник наследуемой природной устойчивости — линия B 52, а также несколько генотипов (BS9, B 86 и другие), созданных с ее использованием (Barry, 1989; Guthrie et al., 1970, 1989). В устойчивости свернутых в воронку листьев определяющую роль играют вещества вторичного обмена (Beck, 1957). Уже в 50-х г.г. прошлого века было выделено, по крайней мере, два химических компонента, влияющих на устойчивость листьев (Beck et al., 1957). Один из них был идентифицирован как 6-метокси-2,3-бензоксазолинон (6-МБОА) (Smissman et al., 1957). Второе соединение было идентифицировано как 2,4-дигидрокси-7-метокси-1,4-бензоксазин-3-он (ДИМБОА) (Klun et al., 1967). ДИМБОА обнаружил высокий токсический, антифидантный и репеллентный эффект, связанный с нарушением обменных процессов, ингибированием питания, сдерживанием роста гусениц, снижением массы тела и плодовитости имаго (Gahukar, 1979; Campos et al., 1988), и его связь с устойчивостью кукурузы очень хорошо прослежена (Klun et al., 1970, 1973). Полагают, что мишенью действия бензоксазолинонов является энергетический обмен; на митохондриях млекопитающих установлено, что ДИМБОА ингибирует перенос электронов в электроннотранспортной цепи и, кроме того, ингибирует процесс образования АТФ (Niemeyer et al., 1987). При питании источником корма с повышенным содержанием ДИМБОА у гусениц отмечается активизация окислительных ферментов, обнаруживаются другие адаптивные сдвиги в обмене, приводящие к усилению экскреции, депонированию и метаболизму гидроксамовых кислот (Philogène, Arnason, 1988). ДИМБОА и родственные ему соединения широко распространены среди злаковых (Zuñiga et al., 1983). В естественном состоянии ДИМБОА не содержится в тканях растений, а является продуктом деградации гликозида 4-0-гликозил-2,4-дигидрокси-7-метокси-1,4-бензоксазин-3-она, который при повреждении тканей ферментативно гидролизуется до аглюкона ДИМБОА. ДИМБОА сравнительно нестоек и легко превращается в 6-МБОА (Woodward et al., 1978; Perez, Niemeyer, 1986). Полагают, что ДИМБОА служит основным фактором устойчивости листьев кукурузы, а по концентрации продукта его разложения (6-МБОА) можно судить о его первоначальном содержании в растении и, соответственно, устойчивости (Klun et al., 1970, 1973; Russell et al., 1975; Robinson et al., 1982, 1982a; Rojanaridpiched et al., 1984; Tseng et al., 1984 и др.). Уровень концентрации ДИМБОА наследуется количественно с преобладанием аддитивных и аддитивно-аддитивных эпистатических эффектов, хотя доминирование и иные эпистатические эффекты также обнаруживаются при отдельных скрещиваниях (Klun et al., 1970; Russell et al., 1975). Косвенный отбор на устойчивость к кукурузному (стеблевому) мотыльку по концентрации ДИМБОА оказался не менее эффективным, чем прямой отбор по поврежденности листьев растений (Tseng et al., 1984). ДИМБОА не единственный фактор антибиоза листьев кукурузы. Некоторые из латиноамериканских генотипов содержат так же мало ДИМБОА, как и неустойчивые стандарты, однако они устойчивы к повреждениям кукурузным (стеблевым) мотыльком (Sullivan et al., 1974; Manuwoto, Scriber, 1985). Концентрация ДИМБОА у американских образцов кукурузы в значительной мере является функцией географической широты местности, а также высоты над уровнем моря, что предполагает существование зависимости концентрации этого соединения от обилия местных патогенных организмов (Reid et al., 1990). Полагают, что помимо ДИМБОА в устойчивости листовых воронок кукурузы могут участвовать также кремнийсодержащие соединения, гемицеллюлоза, лигнин (Rojanaridpiched et al., 1984). В зависимости от этапа иммунологического изучения материала могут применяться разные планы экспериментов: - первоначальный скрининг растительного материала (коллекционных и селекционных номеров);
- изучение иммунологических свойств у образцов, отобранных на этапе 1;
- проверка на экологическую стабильность иммунологических свойств;
- изучение донорских свойств у выделившихся источников устойчивости.
Этап первоначального скрининга имеет целью отбраковать крайне неустойчивые формы при большом объеме материала (сотни и тысячи номеров) и дефиците рабочей силы, средств и времени, так что вполне допустим посев в одном повторении с минимальной площадью делянки (до 1 м², 5-гнездная однорядковая делянка) с включением стандартного генотипа через 20-30 номеров. Оценивается антибиотическая устойчивость (по степени повреждения листьев). При получении образцом оценки 6 и более баллов он может быть выбракован как неустойчивый. Отсутствие существенных (более чем в два балла) различий оценок повторений стандартного образца свидетельствует о выровненности фона заселения. В случае интенсивного естественного фона (если заселено не менее 30-40% растений), допустимо проведение оценок поврежденности листьев без проведения искусственного заселения. Образцу присваивается максимально высокая оценка поврежденности, обнаруженная на делянке. Заслуживают внимания различия в поврежденности образцов, достигающие двух баллов. Как правило, при последующем изучении в повторениях, такие образцы дифференцируются статистически достоверно. На этапе изучения иммунологических свойств у образцов, прошедших первоначальный скрининг, количество номеров сокращается до такой степени, когда рационально использование делянок больших размеров, высеянных в повторениях (как правило, в трех-четырех). Образцы внутри повторений рендомизируются. Площадь делянки увеличивается до 3,4-4,9 м² (15-20-гнездная однорядковая делянка). В каждом повторении стандартный генотип повторяется не менее двух раз. Это делается для того, чтобы оценить достоверность опыта. В том случае, если оценки, полученные одним и тем же образцом (стандартом), высеянным два раза, будут выходить за пределы наименьшей существенной разницы, опыт приходится браковать. Как правило, оценки антибиотической устойчивости отличаются стабильностью; меньшая стабильность оценок свойственна ломкости и уровню скрытых потерь урожая зерна от вредителя. При оценке поврежденности листьев проводят искусственное заселение 5-7 растений на делянке, при оценке выносливости — все растения или в крайнем случае не менее 10. Краевые растения на внешней (где установлены этикетки) и на внутренней дорожке используются как защитные. При обеспечении выровненного интенсивного фона заселения уровень устойчивости образца может быть определен в течение одного цикла изучения (одного года). Характеристика выносливости требует как минимум двух-трехлетнего изучения. Для проверки на экологическую стабильность устойчивости выделившиеся образцы наряду со стандартами высеваются в разных экологических зонах, при различных сроках посева. Схема опыта — такая же, как при изучении иммунологических свойств (этап 2). Степень экологической стабильности (или пластичности) оценивается разными методами, среди которых наиболее распространены модели Эберхарда-Рассела (Eberhart, Russell, 1966). На последнем этапе проводится изучение донорских свойств у выделившихся источников устойчивости. Требуется установить наследуется ли устойчивость и какого можно ожидать повышения устойчивости в гибридных комбинациях от скрещивания с источником устойчивости. Для этого проводят испытания линий на комбинационную способность. Различают общую комбинационную способность (ОКС) и специфическую (СКС). Первая характеризует средний вклад линии по отклонению от среднего по всем гибридным комбинациям, а отклонение фактически наблюдаемых значений от ожидаемых на основании оценок ОКС будет характеризовать СКС линий. Практически для выявления комбинационной способности применяют методы поликросса, тест-кросса и диаллельных скрещиваний. Теория и практика проведения диаллельных скрещиваний обоснованы в работах Б. Гриффинга (Griffing, 1956, 1956a); подробное описание расчетов можно найти и в других руководствах (напр., Фолконер, 1985). Испытания гибридов диаллельных схемы (часто используется модель 4 — без реципрокных комбинаций) проводятся по той же схеме, как и на этапе 2. Для увеличения точности желательно увеличить число повторений минимум до 6 (оценка антибиотической устойчивости) или 8 (оценка выносливости). Хороший пример использования диаллельных скрещиваний для оценки антибиоза кукурузы в отношении кукурузного (стеблевого) мотылька можно найти в работах Д.С. Переверзева (1978, 1980), а выносливости — В.С. Сотченко и соавторов (1989). Следует подчеркнуть, что ценность передаваемых источников устойчивости для селекционеров значительно возрастает, если охарактеризованы их генетические свойства. Выявление устойчивых форм требует создания искусственных фонов заселенности. Лишь в редких случаях и то на первоначальном этапе изучения можно ограничиться проведением оценок на естественном фоне заселения. Работа по созданию фона заселения складывается из следующих этапов: 1) заготовка живого материала в природе и (или) его разведение в лаборатории; 2) получение стадии развития вредителя, с помощью которой создается фон заселения (яйца или гусеницы 1 возраста); 3) заселение растений. В массовом масштабе получать яйца кукурузного (стеблевого) мотылька можно при разведении насекомых на искусственных (полусинтетических) питательных средах (Guthrie, 1982). Детальное описание технологии массового разведения кукурузного (стеблевого) мотылька в промышленных масштабах можно найти в публикации И.Д. Шапиро и соавторов (1980). Исходный живой материал заготавливается осенью (сентябрь-октябрь). После того, как гусеницы закончили питание и ушли в диапаузу, выбирают участки на полях кукурузы, в сильной степени поврежденные кукурузным (стеблевым) мотыльком. Выше численность насекомых на орошаемых участках. Стебли срезают, увязывают в снопы (или помещают в мешки из бумаги) и привозят в лабораторию. Стебли хранят на холоде, в недоступном для мышей месте. В течение ноября-декабря они должны быть порезаны (стебель расщепляется с помощью ножа), из них извлекают гусениц, помещаемых в 0.5-0.75 л стеклянные банки по 50 особей в каждой. В сосуд предварительно помещается гофрированная бумажная лента, используемая как субстрат для коконирования и успешной перезимовки гусениц. Банки закрывают чашками Петри или двумя слоями бязи, ставят вниз горлышком. В течение зимы насекомых содержат в неотапливаемом помещении. Низкие температуры (-30°C и ниже) гусеницы переносят легко. На 100 оцениваемых образцов (из расчета по 15 заселяемых растений в каждом) заготавливают не менее 1000 гусениц (с учетом 30-40% смертности за период зимовки и в период реактивации). В отдельные годы смертность может превышать средний уровень, достигая 60%. Необходимое количество заготавливаемых стеблей рассчитывают по пробным резкам в поле. За период хранения от срезки в поле и до извлечения гусениц последние способны покидать стебли, особенно при температуре выше 15°C. Поэтому необходимо заготавливать стебли, по крайней мере, с небольшим запасом (10-15%) по отношению к расчетному их количеству. Сразу после посева гусениц реактивируют. Для этого банки переносят в термостат, где поддерживают температуру 26-28°C. Перед этим необходимо хорошо смочить бумагу, в которой находятся гусеницы. Увлажнение повторяют по мере подсыхания бумаги (в течение 2-3 недель 1-4 раза). Недостаточное увлажнение тормозит окукливание, избыточное — способствует распространению грибной инфекции. Оптимум достигается следующим образом: бумага должна быть мокрой сверху донизу, но на дне банки не должно быть стоячей воды. Через 10-12 дней после увлажнения начинается окукливание, еще через 7-8 дней — начинается вылет первых бабочек. Как дополнительный источник живого материала могут быть использованы взрослые насекомые — бабочки, отловленные в природе. В зоне с одной генерацией плотность популяции часто весьма высока (на светоловушку за ночь попадает до 50 и более особей). В отдельные годы численность бабочек перезимовавшего поколения в зоне с двумя генерациями также бывает высокой и насекомых можно отлавливать на источник ультрафиолетового освещения. Можно использовать разные способы содержания имаго для получения кладок яиц в лаборатории. Наиболее простой и одновременно наиболее трудоемкий способ — содержание насекомых в 0.5 л банках. Способ этот используется при небольшом объеме работ: заселении 300-500 делянок. Банки занимают относительно большой объем, а пересадка бабочек при извлечении партии яиц требует много времени. Вылетевших за ночь имаго рассаживают по 2-3 пары на банку, куда предварительно помещают цилиндрик из парафинированной бумаги или пергамента. Сверху банки закрывают куском марли, закрепляют резинкой, и помещают мокрую вату. Через 2-3 дня появляются первые кладки. Смену бумажек с яйцами производят через 3-4 дня после появления на них яиц; бабочек пересаживают с помощью стеклянных стаканчиков. Не следует допускать развития яиц до стадии «черной головки» (перед отрождением из яиц через хорион просвечивает потемневшая головная капсула гусениц). Второй способ — содержание бабочек в цилиндрах стандартного размера (высота 35-40 см, диаметр 20-25 см). В такие садки можно поместить до 80-100 пар бабочек. Для манипулирования насекомыми может быть использован включенный через реостат пылесос (рис. 2); с его помощью можно за считанные минуты перенести из садка в садок сотню бабочек. Перед пересадкой имаго в садки вставляют и закрепляют булавками или скрепками минимум в двух местах лист парафинированной бумаги или пергамента, на который самки откладывают яйца. Сверху цилиндр накрывают куском марли, последнюю закрепляют резинкой, на марлю помещают мокрую вату. Ускорение манипулирования бабочками по сравнению с первым способом — пяти-шестикратное. Способ особенно удобен, если используются бабочки, отловленные в природе на ультрафиолетовый свет. Способ вполне оправдывает себя при объеме работ по заселению около 1.5-2.0 тыс. делянок. Недостатком как первого, так и второго способов является то, что бабочки откладывают некоторое количество яиц на марлю (особенно под ватным тампоном); такие кладки нельзя использовать для заселения растений. 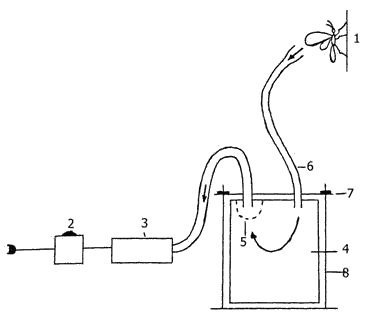 | Рис. 2. Принципиальная схема устройства для пересадки чешуекрылых. 1 – имаго, 2 – лабораторный автотрансформатор, 3 – пылесос, 4 – садок для сбора насекомых, 5 – предохранительная сетка от попадания насекомых внутрь пылесоса, 6 – шланг для сбора насекомых, 7 – верхняя съемная крышка, 8 – система крепления верхней крышки. Стрелками показано движение воздуха в системе. |
Третий способ — содержание бабочек в садках, изготовленных из проволоки. Каркас садков — деревянный или металлический, изнутри полностью выстлан медной или бронзовой сеткой с мелкими ячеями около 5 мм. Наиболее оптимален садок высотой 60 см, размерами дна 30 × 30 см². Внутреннее покрытие сеткой предохраняет от откладки бабочками яиц на гладкую поверхность каркаса. Сверху садок закрывается съемной крышкой из проволочной сетки с размерами ячей около 5 мм. В садок помещают куколок, которых выбирают периодически из банок с реактивированными гусеницами. Плотность куколок в таком садке можно довести до 300 особей. На крышку сверху помещают лист парафинированной бумаги, пергамента или полиэтиленовой пленки и закрепляют его. Самки откладывают яйца через сетку на бумагу, которую сменяют ежедневно. Откладка яиц в садке продолжается около двух недель. Садки опрыскивают водой минимум дважды в день. В отличие от первых двух способов, рассчитанных на последующее заселение растений кладками яиц, третий способ применяется при заселении гусеницами 1 возраста. В том случае, если объем работ по заселению растений не превышает 5-6 тыс. делянок, можно проводить заселение кладками яиц. Кладки вырезают ножницами (или используют пробойник для пробок), при этом размер бумажки, на которой они располагаются, не должен превышать 15 мм. Кладки раскладывают по чашкам Петри (удобны чашки диаметром 20 см). Верхнюю крышку следует постоянно смачивать водой (необходимо, чтобы вода не попадала непосредственно на кладки яиц), т.к. низкая влажность воздуха вызывает сильную гибель яиц. Яйца можно задерживать в развитии, помещая их в холодильник при температуре 4°C на период не более одной недели. При 28°C развитие яиц длится двое суток, после чего наступает отрождение гусениц. Поскольку при первом и втором способе содержания бабочек партии яиц получаются разновозрастными, требуется минимум дважды в день просматривать чашки и выбирать (с помощью пинцета) потемневшие кладки. Если объем работ по заселению превышает 7 тыс. делянок, удобнее заселять растения гусеницами 1 возраста. В этом случае для откладки яиц бабочкам дают листы тонкой парафинированной бумаги или тонкого полиэтилена. С плотных листов кладки отстают плохо и травмируются. После снятия с садка листы с кладками должны в течение не менее 3-4 час выдерживаться при низкой влажности воздуха (около 50%). Для снятия кладок с листа последний пропускают обратной стороной вдоль металлической пластинки с острым краем. Кладки легко отваливаются, а чтобы они не слипались, в емкость, куда падают кладки, добавляют крахмал. Кладки помещают в сосуды, стенки которых спрыснуты дистиллированной водой. Легкими вращательными движениями добиваются, чтобы кладки равномерно прилипли к стенкам сосуда; последнее предотвращает слипание кладок в комок. Сверху сосуд закрывают мокрым листом бумаги и кладки инкубируют при комнатной температуре в течение 3-4 суток; при этом бумажную крышку следует периодически увлажнять. Перед отрождением кладки начинают «чернеть»; в это время необходимо сменить мокрый лист крышки бумаги на сухую, плотно прилегающую стеклянную крышку. Сосуды перед отрождением гусениц следует держать в темноте, поскольку на свету гусеницы начинают активно перемещаться в направлении источника света, сбиваясь в плотный комок. Это приводит к повышенной смертности насекомых, затрудняет последующую работу с ними. После того, как 90-100% гусениц отродилось, в сосуд насыпают крупу из мелкораздробленных и просеянных через сито с отверстиями 1 мм кочерыжек кукурузы. Насыпанную в сосуд крупу осторожно перемешивают для того, чтобы гусеницы равномерно распределились по объему. Крупу с гусеницами просеивают через сито с отверстиями диаметром 3 мм для удаления кладок с неотродившимися гусеницами, а также остатков хорионов. Смесь из крупы с гусеницами пересыпают через воронку по пластмассовым бутылям объемом 0.5 л. Удобно использовать пустую и тщательно промытую тару из-под химических реактивов, где на горлышке имеется винтовая резьба. Такая бутылка навинчивается на специальное устройство для механического заселения растений, именуемое «базукой» (Mihm et al., 1978; Wiseman et al., 1980) (рис. 3, 4).  | Рис. 3. Механическое устройство «базука», предназначенное для искусственного заселения растений гусеницами чешуекрылых I возраста. |
После заполнения пластмассовой бутыли и закрепления ее на «базуке» следует как можно быстрее произвести заселение растений. До использования бутыль со смесью в закрытом виде можно держать на холоду (например, в термосе со льдом). Заселенные «базукой» растения легко отличимы от незаселенных, т.к. на листьях сохраняются остатки крупы, оплетенные паутинными нитями гусениц. В то же время заселенные кладками яиц растения, по крайней мере, пока не проявятся первые признаки повреждения листьев, неотличимы от незаселенных (Хроменко и др., 1988). Лучшие результаты дает заселение растений утром или вечером, поскольку гусеницы успевают начать питание до дневной жары и не подвергаются воздействию прямых солнечных лучей. Фаза заселения — 6-7 развитых листьев. Нагрузка — в зависимости от целей опыта. При скрининге можно ограничиться 40 яйцами или гусеницами/растение. Кладки помещают в листовую воронку (средний размер кладки 25 яиц) с помощью пинцета. При этом яйца не должны касаться поверхности листьев — это может привести их к гибели. В то же время нельзя помещать кладки близко от верхушки раструба — кладки могут быть «вынесены» быстро растущими листьями на поверхность и их унесет ветром или высушит солнце до отрождения гусениц. Кладки должны быть в стадии «черной» головки — т. е. за несколько часов до отрождения гусениц. Заселение в более ранние стадии развития яиц неблагоприятно отражается на их выживаемости. При заселении «базукой» ствол аппарата помещают в листовую воронку, затем производят «выстрел». При наличии росы ствол «базуки» может «залипнуть» — забиться крупой и порции будут неравномерными или даже часть растений вообще останется незаселенной. Поэтому следует особое внимание обращать на выход крупы из ствола, а также периодически легкими круговыми движениями производить перемешивание крупы с гусеницами внутри бутыли, укрепленной на корпусе «базуки». Последнее необходимо для поддержания одинаковой плотности гусениц в смеси (насекомые имеют тенденцию ползти вверх). Желательно процесс заселения производить дважды: например, по 40 гусениц на каждое растение с интервалом в два дня. Заселение опытных растений удобно производить со стороны внешней дорожки. 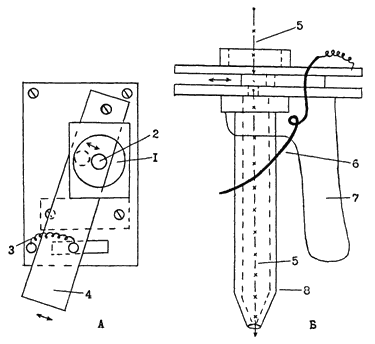 | Рис. 4. Схематическое изображение «базуки» сверху (А) и сбоку (Б). 1 – место крепление бутыли со смесью крупы и гусениц; 2 – рабочее отверстие, через которое просыпается смесь из бутыли в трубу, что происходит в момент совмещения рабочего отверстия с отверстием, просверленным в подвижной планке, при нажатии на спусковой крючок; 3 – пружина, отводящая подвижную планку в исходное положение после нажатия на спусковой крючок; 4 – подвижная планка с отверстием; 5 – путь смеси крупы и гусениц внутри корпуса «базуки», прерываемый подвижной планкой, находящейся в исходном положении; 6 – спусковой крючок, перемещающий подвижную планку из исходного положения в рабочее; 7 – рукоятка; 8 – ствол «базуки», направляющий смесь крупы и гусениц в листовую воронку растения. Стрелками обозначено перемещение подвижной планки. |
В настоящее время предложено несколько способов оценки устойчивости кукурузы к кукурузному (стеблевому) мотыльку. Здесь приведены лишь те, что наиболее удобны для селекционных целей. Оценивают антибиотическую устойчивость кукурузы на стадии листовой воронки по степени поврежденности листьев. Для этого используют шкалу Гатри с соавторами (Guthrie et al., 1960), усовершенствованную В. Вильямсом и Ф. Дэвисом (Williams, Davis, 1984). Оценку поврежденности листьев проводят через 25 дней после заселения (рис. 5).  |  | Рис. 5. Листья кукурузы, сильно (слева) и слабо (справа) поврежденные гусеницами кукурузного (стеблевого) мотылька первого поколения. |
На устойчивых генотипах кукурузы гусеницы гибнут в I-II возрастах, в результате на листьях сохраняются лишь немногочисленные маленькие отверстия (размером с булавочный укол). На неустойчивых образцах гусеницы активно питаются и развиваются, о чем свидетельствуют многочисленные крупные отверстия, оставленные гусеницами 4-5 возрастов (рис. 5). Оценивают уровень выживаемости гусениц на растениях по 9 балльной шкале степени поврежденности листьев: - 1 балл – небольшое количество отверстий типа булавочных проколов;
- 2 балл – небольшое количество отверстий как от дроби на отдельных листьях;
- 3 балл – повреждения как от дроби на многих листьях;
- 4 балл – помимо повреждений как от дроби, на отдельных листьях имеются более крупные удлиненной формы выгрызы;
- 5 балл – такие выгрызы имеются на большом числе листьев;
- 6 балл – помимо удлиненных выгрызов на ряде листьев имеются единичные крупные выгрызы (длиной 2.5 см и более);
- 7 балл – крупные выгрызы отмечаются на половине листьев;
- 8 балл – крупные выгрызы отмечаются на двух третях листьев;
- 9 балл – крупные выгрызы отмечаются на всех (или почти всех) листьях
По устойчивости образцы ранжируются следующим образом: - 1-2 балла — устойчивые
- 3-4 балла — умеренно-устойчивые
- 5-6 баллов — неустойчивые
- 7 баллов и выше — высоко неустойчивые.
В случае раннеспелых генотипов (ФАО 200 и ниже) образцы принято подразделять на устойчивые при повреждении 1-3 балла, промежуточные по устойчивости — 4-5 баллов и неустойчивые — 6 баллов и выше. Следует подчеркнуть, что заселение крайне важно осуществлять в рекомендованную фазу развития (6-7 листьев). Следует учесть, что раннеспелые формы формируют немного листьев (11-12), тогда как у позднеспелых их гораздо больше (17-19 и более). Сравнивать по устойчивости к вредителю можно лишь генотипы с одинаковой скороспелостью. Для более детального изучения выделенных по устойчивости форм полезно использовать дополнительные критерии, характеризующие антибиоз растений: количество червоточин, туннелей и гусениц на растении, а также суммарную длину туннелей, проделанных гусеницами в стебле. Анализ растений по этим показателям производится примерно через месяц после заселения. Все указанные показатели характеризуют жизнедеятельность гусениц старших возрастов (в основном последнего пятого возраста) и поэтому тесно коррелированы (на уровне 0.8-0.99), поэтому вполне возможно использовать любой из них. Для ускорения оценки вместо указанных выше показателей можно использовать показатель источенности стебля, измеряемый в баллах: - 1 балл — ходов нет
- 3 балла — источено до 25% длины междоузлий
- 5 баллов — до 50% длины междоузлий
- 7 баллов — до 75% длины междоузлий
- 9 баллов — до 100% длины междоузлий.
Стебель разрезается вдоль от основания до узла прикрепления початка (стебель выше початка часто обламывается, теряется и лучше эту часть стебля исключить из анализа вообще) и визуально определяется средневзвешенный по междоузлиям балл источенности. Практика показывает, что оценки степени источенности стебля высоко достоверно коррелируют с количеством червоточин, туннелей, гусениц и суммарной длиной туннелей в растении. Показатель источенности особенно рекомендуется применять для оценки устойчивости кукурузы (в дополнение к оценке поврежденности листьев) в зонах с развитием одного поколения кукурузного (стеблевого) мотылька. Лёт бабочек обычно растянут, кладки яиц помещаются на растения не только в фазу листовой воронки, но и в фазы выметывания и даже цветения. Поэтому механизмы устойчивости листьев раннеспелой кукурузы способны противостоять только части популяции гусениц вредителя. В этих условиях дополнительные критерии оценки антибиоза приобретают особую ценность и актуальность. Помимо критерия источенности стебля можно воспользоваться и другими показателями (напр., Guthrie, 1971; Guthrie et al., 1978.). Наиболее детальное изучение устойчивости включает также оценку выносливости к повреждениям. Различают два вида выносливости — устойчивость к ломкости (т. е. видимым потерям урожая) и снижению продуктивности (скрытым потерям урожая). При большом количестве растений на делянке можно оценивать ломкость процентом поломанных ниже початка (включая обломы ножки початка) растений по шкале: - 1 балл — сломов нет
- 2 балла — имеются сломы метелок, сломов стебля нет
- 3 балла — имеются отдельные сломы стебля выше початка, ни одного слома ниже початка нет
- 5 баллов — имеются сломы стебля на уровне початка
- 7 баллов — 1-3 растения (из 15-20) имеют сломы стебля ниже початка (включая обломы ножки початка)
- 9 баллов — число сломов стебля ниже початка (включая обломы ножки початка) более 5.
Шкала рассчитана для применения на однорядковых делянках стандартного размера (площадью 4,9 м²) при густоте стояния растений 60-80 тыс. на га (т. е. 30-40 растений на делянке). При проведении оценок на делянках большего размера шкала может быть легко модифицирована. Ломкость оценивают перед уборкой с учетом продолжительности перестоя. Перестой после созревания более 20 дней не рекомендуется, т.к. диагностика природы полегания стеблей (от поражения стеблевыми гнилями или повреждением кукурузным (стеблевыму) мотыльком, либо их совместного действия) затруднена. При оценке выносливости генотипов кукурузы к повреждениям кукурузным (стеблевым) мотыльком, вызывающим снижение продуктивности растений, обычно используется стандартная процедура, описанная в ряде методических рекомендаций. Наиболее последовательно она реализуется в испытаниях, проводимых Международной рабочей группы по кукурузному (стеблевому) мотыльку IWGO. Тестируемые образцы выращивают на однорядковых делянках в 3 рендомизированных повторениях. На делянке — 25 растений. Случайным образом выбирается по две группы растений, каждая в количестве 5 растений. Одна группа (вариант А) подвергается стандартному заселению кукурузным (стеблевым) мотыльком (по 80 яиц/растение), другая — обрабатывается гранулированным инсектицидом как контроль (вариант В). При этом 2 краевых растения с каждой стороны делянки используются как защитные. Между вариантами А и В должно быть также по крайней мере одно защитное растение. По разнице в продуктивности растений в вариантах А и В, выраженной в процентах к контролю, судят о выносливости генотипа. Процедура уборки — стандартная, с пересчетом на 14% влажность зерна. Кроме того, перед уборкой измеряется средняя высота растений в вариантах А и В. Разницу по высоте также переводят в процент снижения высоты по отношению к контролю. Как показывают международные материалы, оба критерия высоко достоверно коррелируют между собой. Ломкость и снижение продуктивности растений определяются как физиологическими особенностями генотипов, так и зависят от плотности гусениц на растениях. Последняя в опытах определяется в первую очередь антибиотической устойчивостью генотипов и отчасти зависит от привлекательности растений для гусениц старших возрастов. Как показывает практика, стабильность проявления антибиоза кукурузы к вредителю существенно выше, чем таковая ломкости и снижения продуктивности под воздействием повреждения насекомым в разных условиях среды. Этот же вывод справедлив и в отношении наследуемости. Антибиотически устойчивые формы растений способны не только предотвратить большие потери урожая, но и вызывают эффект последействия: снижается вероятность массового размножения насекомого в следующих поколениях. Таким образом, антибиозу принадлежит приоритетное значение, и его оценка должна проводиться в первую очередь. Оценка на выносливость служит дополнением. Наиболее простым способом выделения устойчивых генотипов служит использование скаттер-диаграмм (Ortega et al., 1980; Coтченко и др., 1989). Суть подхода состоит в том, что в системе координат (по оси абсцисс — степень повреждения листьев, по оси ординат — показатель выносливости — видимые или скрытые потери урожая) генотипы изображаются точками. Проводится линия регрессии, на которой восстанавливается перпендикуляр, разделяющий пополам множество точек с координатами xi и yi. В левом нижнем квадранте, образованном линией регрессии и перпендикуляром, локализуются генотипы, сочетающие оба механизма устойчивости. Литература - Вилкова Н.А., Иващенко В.Г., Фролов А.Н., Чумаков М.А., Шапиро И.Д., Навроцкая Н.Б., Инглик П.В., Рабичук А.В., Хроменко А.С., Чучмий И.П. Методические рекомендации по оценке кукурузы на комплексную устойчивость к вредителям и болезням. М.: ВАСХНИЛ, 1989. 43 с.
- Вилкова Н.А., Шапиро И.Д., Фролов А.Н., Чумаков М.А. Изучение устойчивости самоопыленных линий кукурузы к кукурузному мотыльку по Программе IWGO // Инф. бюлл. ВПС МОББ. 1988. № 24. С. 57-64.
- Иващенко Л.С. Влияние антибиотических факторов кукурузы на метаболизм кукурузного мотылька // Инф. бюлл. ВПС МОББ. 1988. № 24. С. 35-40.
- Пайнтер Р. Устойчивость растений к насекомым. М.: ИЛ, 1953. 443 с.
- Переверзев Д.С. Особенности накопления жира гусеницами стеблевого мотылька Ostrinia nubilalis Hbn. (Lepidoptera, Pyralidae) в зависимости от сортовой устойчивости кукурузы в зоне с двумя поколениями вредителя // Энтомол. обозр. 1986. Т. 65, Вып. 3. С. 465-469.
- Переверзев Д.С. Особенности наследования признака устойчивости кукурузы к стеблевому мотыльку // Генетика. 1980. т. 16. № 5. с. 853-858.
- Переверзев Д.С. Характер проявления устойчивости диаллельных гибридов кукурузы к стеблевому мотыльку // С.-х. биол. 1978. Т. 13. № 6. С. 923-926.
- Сотченко В.С., Фролов А.Н., Чумаков М.А. Внутри- и межлинейная дифференциация исходного селекционного материала раннеспелой кукурузы по устойчивости к кукурузному мотыльку // Бюлл. ВИЗР. 1989. № 73. с. 43-47.
- Сотченко В.С., Цаган-Манджиев Н.Л., Фролов А.Н. Диаллельный анализ степени бесплодия кукурузы как показателя устойчивости к стрессовым условиям среды // Генетика. 1989. Т. 25. № 5. С. 941-945.
- Фолконер Д.С. Введение в генетику количественных признаков. М.: Агропромиздат. 1985. 486 с.
- Фролов А.Н., Чумаков М.А. Раннеспелые линии кукурузы, устойчивые к стеблевому мотыльку // Селекция и семеноводство. 1990. № 5. C. 29-30.
- Хроменко А.С., Чучмий И.П., Фролов А.Н., Чумаков М.А. Приспособление для искусственного заселения растений кукурузы кукурузным мотыльком // Защита растений (Киев). 1988. Вып. 35. С. 26-29.
- Шапиро И.Д., Васильев С.В., Переверзев Д.С., Вилкова Н.А., Кудрин А.И. Методологические принципы оценки взаимодействия в системе растение-фитофаг в целях оптимизации путей селекции сортов на устойчивость к вредным организмам (на примере изучения устойчивости кукурузы к стеблевому мотыльку Ostrinia nubilalis Hbn.) // Журн. общ. биол. 1979. T. 40, № 3. С. 385-397.
- Шапиро И.Д., Васильев С.В., Переверзев Д.С., Вилкова Н.А., Кудрин А.И. Анализ сложных биологических систем методами современной статистики на примере изучения устойчивости кукурузы к стеблевому мотыльку // Журн. общ. биол. 1980. T. 41, № 1. С. 105-117.
- Шапиро И.Д., Переверзев Д.С., Шура-Бура Г.Б. Методические указания по оценке полевой устойчивости кукурузы к стеблевому мотыльку. Л.: ВИЗР, 1971. 26 с.
- Шапиро И.Д., Переверзов Д.С., Худон М. Возможности управления размножением стеблевого мотылька Ostrinia nubilalis Hbn. (Lepidoptera, Pyralidae) в СССР и Канаде путем использования устойчивых форм кукурузы // Энтомол. обозр. 1979a. Т. 58, Вып. 1. C. 3-14.
- Шапиро И.Д., Хролинский Л.Г., Фролов А.Н., Вилкова Н.А., Притула Г.И., Казымова Е.М., Остроухов М.А., Чумаков М.А., Муретова Н.Н. Методические рекомендации по оценке устойчивости картофеля и кукурузы к главнейшим вредителям. Л.: ВИЗР. 1980. 138 с.
- Шмараев Г.Е. Кукуруза (филогения, классификация, селекция). М.: Колос, 1975. 304 с.
- Abel C.A., Berhow M.A., Wilson R.L., Binder B.F., Hibbard B.E. Evaluation of conventional resistance to European corn borer (Lepidoptera: Crambidae) and western corn rootworm (Coleoptera: Chrysomelidae) in experimental maize lines developed from a backcross breeding program // J. Econ. Entomol. 2000. V. 93, N 6. P. 1814-1821.
- Barry B.D., Darrah L.L., Huckla D.L., Antonio A.Q., Smith G.S., O'Day M.H. Performance of transgenic corn hybrids in Missouri for insect control and yield // J. Econ. Entomol. 2000. V. 93, N 3. P. 993-999.
- Barry D., Zuber M.S., Antonio A.Q., Darrah L.L. Selection for resistance to the second generation of the European corn borer (Lepidoptera: Pyralidae) in maize // J. Econ. Entomol. 1983. V. 76, N 2. P. 392-394.
- Barry D.B. Host plant resistance: maize resistance to the European corn borer (Lepidoptera: Pyralidae) // Proc. 1st Int. Symp. Maize Arthropods, Gödöló, Aug. 1987: Acta phytopathol. et entomol. hung. 1989. V. 24, N 1-2. P. 43-47.
- Baute T.S., Sears M.K., Schaafsma A.W. Use of transgenic Bacillus thuringiensis Berliner corn hybrids to determine the direct economic impact of the European corn borer (Lepidoptera: Crambidae) on field corn in eastern Canada // J. Econ. Entomol. 2002. V. 95, N 1. P. 57-64.
- Beck S.D. Nutrition of the European corn borer, Pyrausta nubilalis (Hübn.). IV. Feeding reactions of first instar larvae // Ann. Entomol. Soc. Amer. 1956a. V. 49, N 4. P. 399-405, 510.
- Beck S.D. The European corn borer, Pyrausta nubilalis (Hübn.), and its principal host plant. I. Orientation and feeding behaviour of the larva on the corn plant // Ann. Entomol. Soc. Amer. 1956. V. 49, N 6. P. 552-558.
- Beck S.D. The European corn borer, Pyrausta nubilalis (Hübn.), and its principal host plant. VI. Host plant resistance to larval establishment // J. Insect Physiol. 1957. V. 1, N 2. P. 158-177.
- Beck S.D., Stauffer J.F. The European corn borer, Pyrausta nubilalis (Hübn.), and its principal host plant. III. Toxic factors influencing larval establishment // Ann. Entomol. Soc. Amer. 1957. V. 50, N 2. P. 166-170.
- Bohn M., Magg T., Klein D., Melchinger A.E. Breeding early maturing European dent maize (Zea mays L.) for improved agronomic performance and resistance against the European corn borer (Ostrinia nubilalis Hb.) // Maydica. 2003. 48: 239-247.
- Burkness E.C., Hutchison W.D., Bolin P.C., Bartels D.W., Warnock D.F., Davis D.W. Field efficacy of sweet corn hybrids expressing a Bacillus thuringiensis toxin for management of Ostrinia nubilalis (Lepidoptera: Crambidae) and Helicoverpa zea (Lepidoptera: Noctuidae) // J. Econ. Entomol. 2001. V. 94, N 1. P. 197-203.
- Buske M.C., Witkowski J.F. Leaf feeding resistance and 1st-brood European corn borer, Ostrinia nubilalis Hübner (Lepidoptera, Pyralidae), larval mortality // J. Kans. Entomol. Soc. 1985. V. 58, N 3. P. 375-377.
- Campos F., Arnason J.T., Philogène B.J.R, Atkinson J., Morand P., Werstiuk N.H. Toxicokinetics and metabolism of DIMBOA (2,4-dihydroxy-7-methoxybenzoxazin-3-one) and MBOA (6-methoxybenzoxazolinone) in the European corn borer Ostrinia nubilalis // Proc. 18 Int. Congr. Entomol., Vancouver, July 3-9, 1988: Abstr. and Author Index. Vancouver, 1988. P. 469.
- Catangui M.A. Transgenic Bacillus thuringiensis corn hybrid performance against univoltine ecotype European corn borer (Lepidoptera: Crambidae) in South Dakota. // J. Econ. Entomol . 2003. V. 96, N. 3. P. 957-968.
- Chiang H.C., Hodson A.C. Distribution of the first-generation egg masses of the European corn borer in corn fields // J. Econ. Entomol. 1959. V. 52, N 2. P. 295-299.
- Chiang H.C., Holdaway F.G. Relative effectiveness of resistance of field corn to the European corn borer, Pyrausta nubilalis, in crop protection and in population control // J. Econ. Entomol. 1960. V. 53, N 5. P. 918-924.
- Chiang H.C. Host variety as an ecological factor in the population dynamics of the European corn borer, Ostrinia nubilalis // Ann. Entomol. Soc. Amer. 1968. V. 61, N 6. P.1521-1523.
- Coppolino F. La ricerca e la resistenza ai parassiti // Ital agr. 1979. An. 116, N 4. P. 279-288.
- Dharmalingam S., Guthrie W.D., Jarvis J.L., Kindler D., Atkins R.E., Tseng C.T., Zhou D. European corn borer (Lepidoptera: Pyralidae): rate of first-generation larval mortality in sorghum hybrids compared with inbred lines of maize during the whorl stage of plant development // J. Econ. Entomol. 1984. V. 77, N 4. P. 929-931.
- Eberhart S.A., Russell W.A. Stability parameters for comparing varieties // Crop Sci. 1966. V. 6, N. 1. P. 36-40.
- Gahukar R.T. Comportement alimentaire et prise de nourriture des chenilles d’Ostrinia nubilalis (Lep. Pyraustidae) en présence de “DIMBOA” // Ann. Soc. entomol. France. 1979. T. 15, N 4. P. 649-657.
- Griffing B. A generalised treatment of the use of diallel crosses in quantitative inheritance // Heredity. 1956. V. 10. p. 31-50.
- Griffing B. Concept of general and specific combining ability in relation to diallel crossing system // Austral. J. Biol. Sci. 1956a. V. 9. N 4. P. 463-493.
- Guthrie W.D. Breeding for insect resistance in maize // Plant Breed. Rev. 1989. V. 6. P. 209-243.
- Guthrie W.D. Mass rearing of crop pests with emphasis on stem- and pod-borers // Insect Sci. and Applic. 1982. v. 3, N 2-3. p. 89-96.
- Guthrie W.D. Resistance of maize to second-brood European corn borers // Proc. 26th Hybrid Corn Industry-Research Conf. 1971. P. 165-179.
- Guthrie W.D., Dicke F.F. Resistance of inbred lines of dent corn to leaf feeding by 1st-brood European corn borers // Iowa State J. Sci. 1972. V. 46, N 3. P. 339-355.
- Guthrie W.D., Dicke F.F., Neiswander C.R. Leaf and sheath feeding resistance to the European corn borer in eight inbred lines of dent corn // Ohio Agric. Exp. Sta. Res. Bull. 1960. N 860. 38 p.
- Guthrie W.D., Hawk J.A., Jarvis J.L. Performance of inbred line DE 811 in hybrid combinations: resistance to first- and second generation European corn borers (Lepidoptera: Pyralidae) // J. Econ. Entomol. 1989. V. 82, N 6. P. 1804-1806.
- Guthrie W.D., Huggsns J.L., Chatterji S.M. Sheath and collar feeding resistance to the second-brood European corn borer in six inbred lines of dent corn // Iowa State J. Sci. 1970. V. 44, N 3. P. 297-311.
- Guthrie W.D., Russell W.A., Reed G.L., Hallauer A.R., Cox D.F. Methods of evaluating maize for sheath-collar feeding resistance to the European corn borer // Maydica. 1978. V. 23. P. 45-53.
- Huber L.L. Mortality of first instar larvae of the European corn borer // Ohio Agr. Exp. Sta. Bull. 1936. N 561. 44 p.
- Hudon M., Chiang M.S. Resistance and tolerance of maize germplasm to the European corn borer Ostrinia nubilalis (Hübner) and its maturity in Québec // Maydica. 1985. V. 30, N 3. P. 329-337.
- Hudon M., Chiang M.S., Chez D. Resistance and tolerance of maize inbred lines to the European corn borer Ostrinia nubilalis (Hübner) and their maturity in Québec // Phytoprotection. 1979. V.60, N 1. P. 1-22.
- Hudon M., LeRoux E.J. Biology and population dynamics of the European corn borer (Ostrinia nubilalis) with special reference to sweet corn in Québec. III. Population dynamics and spatial distribution // Phytoprotection. 1986. V. 67, N 2. P. 93-115.
- Klun J.A. et Cooperators. An evaluation of resistance of 41 corn inbred lines to the European corn borer by chemical analysis of the plant tissues // Rept. Int. Project Ostrinia nubilalis. Phase I Results 1969 and 1970. Budapest, 1973. P. 104-108.
- Klun J.A., Guthrie W.D., Hallauer A.R., Russell W.A. Genetic nature of the concentration of 2,4-dihydroxy-7-methoxy-2H-1,4-benzoxazin-3(4H)-one and resistance to the European corn borer in a diallel set of eleven maize inbreds // Crop Sci. 1970. V. 10, N 1. P. 87-90.
- Klun J.A., Tipton C.L., Brindley T.A. 2,4-Dihydroxy-7-methoxy-1,4-benzoxazin-3-one (DIMBOA), an active agent in the resistance of maize to the European corn borer // J. Econ. Entomol. 1967. V. 60, N 6. P. 1529-1533.
- Labatte J.M., Meusnier S., Migeon A., Piry S., Got B. Natural mortality of European corn borer (Lepidoptera: Pyralidae) larvae: field study and modeling // J. Econ. Entomol. 1997. V. 90, N 3. P. 773-783.
- Luckmann W.H., Decker G.G. A corn plant maturity index for use in European corn borer ecological and control investigations // J. Econ. Entomol. 1952. V. 45, N 2. P. 226-232.
- Manuwoto S., Scriber J.M. Neonate larval survival of European corn borers, Ostrinia nubilalis, on high and low DIMBOA genotypes of maize: effects of light intensity and degree of insect inbreeding //Agric. Ecosyst. and Environ. 1985. V. 14, N 3-4. P. 221-236.
- Marston A.R. Recent progress in breeding borer resistant corn // Quart. Bull. Michigan Agr. Exp. Sta. 1933. N 5. P. 264-268.
- Mihm J.A. Breeding for host plant resistance to maize stem-borers // Insect Sci. and Appl. 1985. V.6, N 3. P. 369-377.
- Mihm J.A., Peairs F.B., Ortega A. New procedures for efficient mass production and artificial infestation with lepidopterous pests of maize // CIMMYT Review. 1978. 138 p.
- Neiswander C.R., Huber L.L. Height and silking as factors influencing European corn borer population // Ann. Entomol. Soc. Amer. 1929. V. 22, N 3. P. 527-542.
- Neiswander C.R., Savage J.R. Migration and dissemination of European corn borer larvae (Pyrausta nubilalis Hübn.) // J. Econ. Entomol. 1931. V. 24, N 2. P. 389-393.
- Niemeyer H., Calcaterra N.B., Roveri O. Inhibition of energy metabolism by benzoxazolin-2-one // Comp. Biochem. and Physiol. 1987. V. 87, Ser. B, N 1. P. 35-39.
- Ortega A., Vasal S.K., Mihm J., Hershey C. Breeding for insect resistance in maize. In: Breeding plants resistant to insects. Maxwell F.G., Jennings P.R., eds. 1980. N.-Y. e.a.: Wiley. p. 371-419.
- Ortega A., Vasal S.K., Mihm J., Hershey C. Breeding for insect resistance in maize // Breeding plants resistant to insects. W.Y. e.a.: J. Wiley & Sons, 1980. P. 371-420.
- Patch L.H. Height of corn as a factor in egg laying by the European corn borer moth in the one-generation area // J. Agr. Res. 1942. V. 64, N 9. P. 503-515.
- Patch L.H. Survival, weight and location of European borers feeding on resistant and susceptible field corn // J. Agr. Res. 1943. V. 66, N 1. P. 7-19.
- Penny L.H., Dicke F.F. European corn borer damage in resistant and susceptible dent corn hybrids // Agron. J. 1959. V. 51, N 6. P. 15-18.
- Perez F.J., Niemeyer H.M. Effect of borate on decomposition of 2,4-dihydroxy-7-methoxy-1-4-benzoxazin-3-one, a hydroxamic acid from Graminae // Heterocycle. 1986. V. 24, N 1. P. 13-16.
- Pesho G.R., Dicke F.F., Russell W.A. Resistance of inbred lines of corn (Zea mays L.) to the second brood of the European corn borer (Ostrinia nubilalis /Hübner/) // Iowa St. J. Sci. 1965. V. 40, N 1. P. 85-98.
- Philogène B.J.R., Arnason J.T. Phytochemical mechanisms of resistance to maize feeding insects // Proc. 18 Int. Congr. Entomol., Vancouver, July 3-9, 1988: Abstr. and Author Index. Vancouver, 1988. P. 102.
- Pilcher C.D., Rice M.E., Higgins R.A., Steffey K.L., Hellmich R.L., Witkowski J., Calvin D., Ostlie K.R., Gray M. Biotechnology and the European corn borer: measuring historical farmer perceptions and adoption of transgenic Bt corn as a pest management strategy // J. Econ. Entomol. 2002. V. 95, N 5. P. 878-892.
- Reed G.L., Brindley T.A., Showers W.B. Influence of resistant corn leaf tissues on the biology of the European corn borer // Ann. Entomol. Soc. Amer. 1972. V. 65, N 3. P. 658-662.
- Reid L., Arnason J.T., Nozzolillo C., Hamilton R. Resistance of maize germ plasm to European corn borer, Ostrinia nubilalis, as related to geographical origin // Can. J. Bot. 1990. V. 68, N 2. P. 311-316.
- Robinson J.F., Klun J.A., Brindley T.A. European corn borer: a nonpreference mechanism of leaf-feeding resistance and its relationship to 1,4-benzoxazin-3-one concentration in dent corn tissue // J. Econ. Entomol. 1978. V. 71, N 3. P. 461-465.
- Robinson J.F., Klun J.A., Guthrie W.D., Brindley T.A. European corn borer leaf feeding resistance: a simplified technique for determining relative differences in concentrations of 6-methoxybenzoxazolinone (Lepidoptera: Pyralidae) // J. Kans. Entomol. 1982. V. 55, N 2. P. 297-301.
- Robinson J.F., Klun J.A., Guthrie W.D., Brindley T.A. European corn borer (Lepidoptera: Pyralidae) leaf feeding resistance: DIMBOA bioaasays // J. Kans. Entomol. 1982a. V. 55, N 2. P. 357-364.
- Rojanaridpiched C., Gracen V.E., Everett H.L., Coors J.G., Pugh B.F., Bouthyette P. Multiple factor resistance in maize to European corn borer // Maydica. 1984. V. 29, N 3. P. 305-315.
- Russell W.A., Guthrie W.D., Klun J.A., Grindeland R. Selection for resistance in maize to first-brood European corn borer by using leaf-feeding damage of the insect and chemical analysis for DIMBOA in the plant // J. Econ. Entomol. 1975. V. 68, N 1. P. 31-34.
- Smissman E.E., Lapidus J.B., Beck S.D. Isolation and synthesis of an insect resistance factor from corn plants // J. Amer. Chem. Soc. 1957. V. 79. P. 4697-4698.
- Sullivan S.L., Gracen V.E., Ortega A. Resistance of exotic maize varieties to the European corn borer, Ostrinia nubilalis (Hübner) // Environ. Entomol. 1974. V. 3, N 4. P. 718-720.
- Troyer F. Development of hybrid corn and the seed corn industry. In: - Maize Handbook. Vol. II: Genetics and genomics. Bennetzen J.L., Hake S., eds. 2009. N.-Y.: Springer. p. 87-114.
- Tseng C.T., Guthrie W. D., Russell W.A., Robbins J.C., Coats J.R., Tollefson J.-J. Evaluation of two procedures to select for resistance to the European corn borer in a synthetic cultivar of maize // Crop Sci. 1984. V. 24, N 6. P. 1129-1133.
- Walker K.A., Hellmich R.L., Lewis L.C. Late-instar European corn borer (Lepidoptera: Crambidae) tunneling and survival in transgenic corn hybrids // J. Econ. Entomol. 2000. V. 93, N 4. P. 1276-1285.
- Williams W.P., Davis F.M. Reaction of a resistant and a susceptible corn hybrid to various southwestern corn borer infestation levels. // Agron. J. 1984. V. 76, N 5. P. 855-856.
- Willmot D.B., Hibbard B.E., Darrah L.L., Pollak L M., Montgomery K., Pratt R.C., Abel C.A., Hawk J.A., Weldekidan T., Foster J.E. Effect of environment on resistance to the European corn borer (Lepidoptera: Crambidae) in maize // J. Econ. Entomol. 2004. V. 97, N 5. P. 1745-1751.
- Wilson T.A., Rice M.E., Tollefson, J.J., Pilcher, C. D. Transgenic corn for control of the European corn borer and corn rootworms: a survey of Midwestern farmers' practices and perception // J. Econ. Entomol. 2005. V. 98, N 2. P. 237-247.
- Wiseman B.R., Davis F.M., Campbell J.E. Mechanical infestation device used in fall armyworm plant resistance programs // Fla Entomol. 1980. V. 63, N 4. P. 425-432.
- Woodward M.D., Corcuera L.J., Helgenson J.P., Upper C.D. Decomposition of 2,4-dihydroxy-7-methoxy-2H-1,4-benzoxazin-3 (4H)-one in aqueous solutions // Plant Physiol. 1978. V. 61, N 5. P. 796-802.
- Zhou D.R., Ju L.L., Wei R.Y., Chen C.C., Gao Y.X., Wen L.P., He K.L., Li X.Z., Liu C.D. Utilization of maize resistance to corn borer and introduction of a resistant single-cross 2D-No.1 // Plant Prot. 1987. V. 13, N 5. P. 16-18.
- Zuñiga G.E., Argandona V.M., Niemeyer H.M., Corcuera L.J. Hydroxamic acid content in wild and cultivated Gramineae // Phytochemistry. 1983. V. 22, N 12. P. 2665-2668.
|
|












