| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В.Г. Иващенко
Html-вариант статьи «Пузырчатая головня кукурузы: этиология, патогенез болезни и проблема устойчивости (уточнение парадигмы)», опубликованной в журнале «Вестник защиты растений», 2011, № 4, с. 40-56. ВведениеПузырчатая головня кукурузы Ustilago maydis DC. (Cda.) – широко распространенная болезнь, обычно вызывающая недобор 1-6% урожая, но в бессменной культуре или отдельные годы потери могут быть значительно выше.
На территории бывшего СССР болезнь распространена повсеместно, сильнее на юге европейской части в районах с неустойчивым или недостаточным увлажнением. В 60-е годы ХХ века пораженность растений в степной зоне Украины составляла 12-19% (Немлиенко,1957), но в отдельные годы пораженность кукурузы в Крыму достигала 20-40% (Тихонов, Тихонов, 1960), на юге Украины – 71% (Ключко и др., 1976), в Молдавии – 25-40% (Юрку и др., 1982), в Приморском крае – 60-75% (Азбукина, 1962). С ростом в 60-е годы площадей кукурузы на зерно, силос и зеленый корм до 18-20 млн га расширился и ареал пузырчатой головни. Болезнь стали отмечалать в Московской (до 30%) и Ленинградской (единично) областях, зарегистрировали ее также в Татарии и Башкортостане, Псковской, Новгородской, Калининградской, Рязанской, Ярославской, Горьковской, Кировской, Челябинской, Омской, Новосибирской областях, в северных районах Дальнего Востока (Калашников, Шапиро, 1962). Распространенность и вредоносность болезни сильно варьирует в зависимости от устойчивости растений, применяемой агротехники и климатических условий. Заражение различных органов (особенно апекса побега) на ранних этапах органогенеза в целом более вредоносно, чем стебля в период выдвижения метелок или несформировавшегося початка. Однако при заражении початков могут сформироваться наиболее крупные галлы (до 15 см), приводящие к бесплодию растений (Войтович, 1958; Кобелева, Бляндур, 1977 и др.). Установлено (Немлиенко,1957), что при естественном поражении растений крупные галлы снижают урожай в среднем не менее, чем на 60%, галлы средней величины – на 25%, небольшие вздутия – на 10%. Согласно полученным в США (Immer, Christensen, 1928), а позже на юге Украины (Ключко и др.,1976) данным, усреднённая вредоносность болезни составляет 25.0-26.5 и 20.3% соответственно. U. maydis поражает только кукурузу и ее ближайших родственников – виды теосинте (Euchlaena mexicana, E. perennis), в России не произрастающих, что позволяет рассматривать процесс накопления и сохранения инфекции исключительно в связи с сортоустойчивостью, технологией возделывания и защитой кукурузы. Одна из причин появления данной статьи – необходимость внести ясность в терминологию и охарактеризовать вклад тех или иных приемов защиты в оздоровление фитосанитарной ситуации на посевах кукурузы. К сожалению, до сих пор порой публикуются ошибочные рекомендации, касающиеся развития эпифитотийной ситуации пузырчатой головни на кукурузе (табл. 1). Таблица 1. Выдержки из научной, учебной, научно-популярной литературы и рекомендаций по защите растений
Основная цель работы – критически рассмотреть сложившиеся в фитопатологии представления и переосмыслить основные положения существующей парадигмы с учетом данных литературы и собственных материалов автора. Для достижения поставленной цели сначала кратко рассмотрим биоэкологию U. maydis и специфику отношений гриба с питающим его растением. Результаты и обсуждениеЭтиологии пузырчатой головни посвящены многочисленные исследования, начало которых относится к последней четверти 19 века (Breffeld, 1895; Hitchcock, Norton, 1896), а их интенсификация – к первой половине 20 века, когда тщательно были изучены биология, физиологическая специализация и природа устойчивости кукурузы к U. maydis (Garber, Quisenberry, 1925; Immer, 1927; Christensen, 1930). Согласно обзорной информации И.В. Каратыгина (1981) U. maydis – наиболее полно изученный в генетическом отношении вид головневых грибов: составлена его генетическая карта, изучены многие молекулярные механизмы паразитизма, на его примере подтверждена наиболее плодотворная идея молекулярной генетики – гипотеза молекулярных механизмов рекомбинации (Holiday, 1961), расшифрована генетическая система, контролирующая половой процесс посредством «двух локусов по полу» – “a” и “b”. Из них “a” имеет 2 аллели и контролирует только слияние споридий, “b” – имеет множество аллелей и регулирует образование дикариона, его стабильность и кариогамию. U. maydis – тетраполярный вид со множественно-тетраполярным гетероталлизмом, у которого заражение растения и завершение цикла развития гриба вызывают только споридии, различающиеся одновременно по “a” и “b” аллелям (Rowell, De Vay, 1954; Holiday, 1961). Показан низкий уровень дифференциации популяций U. maydis в отношении локуса b типа спаривания, что не исключает модели нейтральной эволюции (Zambino et al., 1997). Многолетними исследованиями была доказана нестабильность физиологических рас U. maydis, обусловленная сильной его изменчивостью по морфологическим, культуральным признакам и патогенности (Stakman, Tyler, Hafstad.et al., 1935; Кузнецов, 1963; Каратыгин, 1968). Новые биотипы (и их совместимые пары – миксобиотипы) гриба могут возникать в результате мутаций в гаплоидной, диплоидной и дикариотической фазах (Каратыгин, 1969). Наличие генетической системы половой несовместимости мицелия из споридий одного типа спаривания препятствует инбридингу в популяции патогена, обеспечивая тем самым поддержание его высокой гетерогенности (Кузнецов, 1963; Салунская, 1969; Barnes е.а., 2004). Широкая вариация по самым различным признакам, в том числе и по вирулентности, характеризует уникальность U. maydis среди головневых грибов, чрезвычайную пластичность его генетической системы. Эти признаки, наряду с огромной плодовитостью гриба и нестабильностью его физиологических рас, изначально обусловили методические трудности в селекции на устойчивость к патогену, а также при осуществлении защитных мероприятий. U. maydis относится к теплолюбивым видам, телиоспоры которого начинают прорастать при 0-5° С и не прорастают выше 35° С (Hutting, 1931). После 4-х лет хранения телиоспор в лабораторных условиях 24% их сохраняли всхожесть, но при естественном распылении в период уборки урожая они теряли всхожесть на 75% к началу лета. Отмирание телиоспор происходит только после достаточного увлажнения и увеличивается с глубиной заделки в почву. Показано, что в средней полосе РФ телиоспоры сохраняются в почве более 11 месяцев (Кузнецов, 1963), а в галлах – до 2-х лет и более. Оптимум для формирования галлов составляет 20-25° C (Schmitt, 1940). Свежесозревшие телиоспоры легко прорастают, но через 1-2 месяца их всхожесть снижается, часто до 50% (Немлиенко, 1957). Телиоспоры не теряют всхожесть, пройдя через пищеварительный тракт животных. Они разносятся на большие расстояния вместе с пылью, прорастают обычно в местах скопления при наличии влаги (осадки, росы): первоначально в воронке листьев, после цветения – в пазухах листьев, а после ночных рос – на других частях кукурузы. Наступление жаркой сухой погоды особенно благоприятно для прорастания телиоспор, споридий и для внедрения в покровную ткань растения (Corn smut Ustilago maydis. Cornell Univ., Dept of Plant Pathology and Plant-Microbe Biol.). Сообщалось (Борггардт, 1932; Ульянищев, 1952), что переносить телиоспоры пузырчатой головни с растения на растение могут насекомые. Так, с наростами пузырчатой головни кукурузы и головни сорных просовидных злаков связан жизненнный цикл личинок Phalaerus politus, питающихся спорами гриба U. maydis (Boving, Graighead,1931). Согласно данным О.Walter (1934) заражение U. maydis происходит путем внедрения инфекционной гифы, образовавшейся из споридий или непосредственно из телиоспоры, причем второй вариант проникновения имеет большее распространение. Этот факт, как отмечает Ф.Е. Немлиенко (1957), представляет большой интерес, поскольку гриб может обходиться минимумом влаги, которой могло бы не хватить для образования базидиоспор, но которой достаточно для прорастания телиоспор. Установлено, что распространенность головни, учитываемую однократно по её видимым проявлениям, необходимо дополнять повторными учетами к периоду созревания (Davis, 1936), поскольку многие поражения нижних початков не видны вследствие их укрытия обертками. Приведенные оригинальные данные об увеличении в 2-3 раза числа пораженных растений с возрастом могут служить показателем наличия инфекции в латентном состоянии и возможности её проявления в форме галлов на узлах стебля. Обширная информация о причинах периодического роста распространения болезни может быть сведена к трем основным положениям: заделка галлов головни в почву снижает частоту встречаемости болезни и степень поражения растений; в засушливые и дождливые сезоны распространенность болезни ниже, её увеличение связано с частыми сменами засушливых условий кратковременными осадками; поранения, наносимые почвообрабатывающими орудиями, насекомыми (шведские мухи, кукурузный мотылек, хлопковая совка), птицами и градом способствуют увеличению распространенности головни. Таблица 2. Основные факторы, способные влиять на развитие пузырчатой головни кукурузы
Известно, что в период наступления засухи (и при частой смене периодов увлажнения засушливыми) снижается тургорность тканей листовой воронки (как проявление структурного иммунитета, что способствуют затеканию инфекционного начала, сформировавшегося ранее в период достаточного увлажнения). Установлено также, что вариация погодных условий статистически достоверно связана с поздней эмбриональной смертностью яиц кукурузного мотылька. Она существенно снижается в период развития первой генерации в условиях повышенной влажности воздуха (r = -0.77), а второй – при повышении влажности воздуха (r = -0.71) и увеличении количества осадков (r = -0.85). С влажностью воздуха (r = -0.90) и суммой выпавших осадков оказалась связанной и ранняя эмбриональная смертность яиц второго поколения (Фролов, Малыш, 2004). Влияние влаги многогранно, но анализ простых взаимосвязей ведет лишь к констатации, реже – выявлению тенденции, тогда как при анализе взаимодействий патогенов и фитофагов – к получению конечных, четко проявляемых результатов, оцениваемых в показателях вредоносности. В перечне рассмотренных факторов обязательны агротехнологические приемы возделывания растений, но в значительной мере контролируемы лишь раневые инфекции, что требует сравнительного рассмотрения отношений как в системе растение-хозяин – патоген, так и в системе растение-хозяин – фитофаг – патоген с целью выявления ключевых звеньев, определяющих наибольшую эффективность сдерживания распространения болезни, её развития и вредоносности. I. Отношения в системе растение-хозяин – патогенПроникновение U. maydis.Согласно данным О.Walter (1934) заражение происходит путем внедрения инфекционной гифы, образовавшейся из споридий или непосредственно из телиоспоры, причем второй вариант проникновения имеет большее распространение. Проникшая в клетку гифа образует тонкий нитевидный мицелий. Слияние тонких гиф от двух разнополых особей (+ и – ) дает начало образованию двухъядерных толстых узловатых внутриклеточных гиф, пронизывающих клетки в разных направлениях (Mundkur, 1949). Споридии, как отмечает И.В. Каратыгин (1981), прорастают незначительным первичным мицелием, распространяющимся обычно лишь в клетках эпидермиса инфицируемого растения. Гифы от прорастающих телиоспор толще (3-4 мкм), чем споридий (2-3 мкм), они распространяются по поверхности кутикулы на расстояние 90-110 мкм и более, прежде чем происходит формирование аппрессориев и последующее внедрение мицелия гриба в ткани кукурузы, причем происходит оно без четко выраженной специализации по типам клеток, и мицелий может распространяться на незначительное расстояние по направлению к меристематическим тканям. Это меристемы боковых вегетативных почек и адвентивных корней, рудиментарных початков, интеркалярная меристема осевых органов, клетки апекса стебля, меристемы листьев, флоральные меристемы, в частности меристемы формирующихся зерновок, а также зона интеркалярного роста листа. Заражение в природных условиях обычно осуществляется сразу несколькими прорастающими телиоспорами, расположенными на поверхности слабо дифференцированных тканей. При этом одна часть телиоспор прорастает с образованием дикариотического мицелия, другая – с образованием споридий. Между дикариотическими мицелиями нередки анастомозы (Каратыгин, 1968; Mills, Kotze, 1981). Колонизация.Особенности колонизации кукурузы U. maydis описаны достаточно подробно (Davis, 1936). Показано, что кукуруза восприимчива к инфекции от периода формирования первого листа до формирования пыльцы в пыльниках, то есть при наличии доступных для инфицирования меристем. При искусственном заражении восприимчивых сортов возбудитель способен проникать в клетки коры корня, но локально, и обнаруживается лишь посредством микроскопии (Sabbagh et al., 2006). Возбудитель внедряется в основном через формирующиеся генеративные органы, почки, молодые листья, но неспособен инфицировать проросток через неповрежденный колеоптиле, поэтому в естественных условиях поражение возбудителем всходов отмечается крайне редко. Инфицирование часто происходит в стадии «листовой розетки», когда растение достигает высоты 30-100 см. Г. Дэвис (1936) считает, что при заражении початков споры проникают между неплотно прижатыми листовыми обертками в начале процесса опыления, но внедрение мицелия через рыльца не происходит. Наиболее восприимчива кукуруза за 10-14 дней до выдвижения метелок, когда меристемы конусов нарастания наиболее открыты и доступны для инфекции. Эти особенности места и способа заражения кукурузы отличают U. maydis от других головневых грибов. Обычно на растении, имеющем галл головни, удается выявить мицелий в различных участках, что является следствием неоднократной инфекции растения в его онтогенезе. Характер распределения мицелия гриба по растению можно оценить как множественно-локальный, причем мицелий способен сохраняться латентно в пазушных почках. В опытах с искусственным заражением трехдневных проростков установлено (Михалевская, 1967), что в зараженных растениях мицелий гриба распространен довольно широко, пронизывая участки тканей различных надземных органов, но лишь на незначительной их части наблюдался рост галлов. Причем распространение мицелия по тканям больного растения не является сплошным. Участки тканей, инфицированные паразитом, но не давшие галлового роста, практически ничем не отличались от здоровых. Этот вывод подтвержден и более поздними исследованиями (Martinez-Espinoza еt аl., 2003). У 95% инфицированных растений мицелий содержался в листовой пластинке первого листа, но галлы на ней формировались редко, лишь в 14% случаев. Почти половина (45%) инфицированных проростков содержали мицелий в мезокотиле, но образования галлов на мезокотиле не отмечено. Отсутствие галлов на мезокотиле подтверждает и Н.И. Салунская (1964). Высокую устойчивость против галлообразования тканей мезокотиля и первого листа авторы связывают с их возрастным состоянием (более старыми в период инокуляции). Далее автор приходит к заключению, что поражение проростков U. maydis не может быть квалифицировано ни как диффузное, ни как локальное (Михалевская,1967). Исследования других авторов (Walter, 1935; Davis, 1936; Scurti, 1950; Борисенко, 1954; Мещерякова, 1959) также позволяют судить о наличии мицелия гриба в тканях взрослых растений далеко за пределами галлов. Данные о распространении мицелия U. maydis в тканях кукурузы приводятся в ряде монографий (Немлиенко, 1957; Christensen, 1963; Каратыгин, 1981) и многочисленных публикациях. Подавляющее большинство исследователей считает пузырчатую головню типично локальным заболеванием, а описания «тотального» заражения проростков, «шнуры» на жилках листьев и другие симптомы – следствием первичной множественной инфекции. Галлогенез.Строение патологически измененных тканей кукурузы, пораженных U. maydis, изучалось в связи с существовавшей ранее точкой зрения, что мицелий гриба не вызывает изменений в первой стадии жизни растений, только с возрастом появляются и быстро прогрессируют желваки вследствие гиперпластического и гиперторофического действия мицелия гриба. Патогистологическими исследованиями (Davis, 1936) установлено, что во вновь образующихся группах молодых клеток, появляющихся в периферической зоне основной паренхимы стеблей и листьев, отсутствует мицелий. Галл разрастается вследствие образования новых групп очень молодых клеток, имеющих тонкую клеточную стенку и обилие протоплазмы. Спустя некоторое время образуется мицелий, который пронизывает всю галловую ткань. Характер роста мицелия в галлах отличается от такового в морфологически нормальных тканях тем, что формируются крупные гроздевидные его скопления. В дальнейшем гифы сегментируются, и из отдельных сегментов формируются телиоспоры. Работами И.В Каратыгина (1971, 1981) показано, что спорогенный мицелий скапливается, как правило, в межклетниках инфицированных тканей, где и начинается формирование сорусов. Установлено (Davis, 1936), что внешне здоровые растения часто могут быть инфицированными в одном или многих местах и продуцировать галлы только при определенных условиях, во многих случаях совсем не обнаруживая признаков заболевания. Это подтверждено и другими исследователями (Михалевская, 1967; Каратыгин, 1981). Изучение проблемы галлогенеза привело к заключению, что скорость роста вздутий зависит от места, условий погоды и, возможно, степени устойчивости растения-хозяина (Scurti, 1950; Christensen, 1963). Наиболее быстро вздутия растут на початках, где прирост их, особенно перед созреванием, может достигать в сутки 4 см в диаметре. Вздутия на листьях и метелках увеличиваются в размерах гораздо медленнее (Немлиенко, 1957). Характерной особенностью патогенеза болезни является увеличение транспирации и снижение содержания сахаров в стебле при поражении различных органов (Hard-Karrer, 1926; Сиденко, Сотула, 1975). При этом, вследствие возрастания вдвое темпов накопления сухого вещества в патологически растущих тканях, на конусе нарастания стебля закладывается меньшее количество зачатков листьев, а рост последних подавляется (Михалевская, 1975). Особенности проявления болезни.О том, что кукуруза наиболее восприимчива к U. maydis, когда её высота достигнет фута (30.5 см), известно еще из работ O.Брефельда (Brefeld, 1895) и других авторов (Клинтон, Хичкок, Нортон, 1896; Платц, 1929). О.А.Платц (1929) было показано, что галлы на узлах стебля редко появляются на кукурузе в первые 70-80 дней от посева или 40 дней после стадии дифференциации. Чаще всего растения начинают поражаться примерно через 40-45 дней после всходов, то есть за 20-25 дней до выдвижения метелок. В опытах с искусственным заражением кукурузы U. maydis Ф.Е. Немлиенко (157) отмечал, что заметное невооруженным глазом головневое пятнышко образуется через 8-12 дней, а зрелое вздутие с вполне жизнеспособными спорами – через 20-24 дня. Сходные результаты получены другими авторами, отмечавшими первые симптомы заболевания через 2-3 недели, а продолжительность периода от начала образования галлов до созревания в них спор – от 7-15 дней до 2-3 недель (Каратыгин,1971; Слепян, Каратыгин, 1973, 1976). Показано, что при инокуляции трехдневных проростков (вакуум-методом) галлы появлялись на листьях и стеблях на 5-7 день после заражения (Михалевская, 1967). И.В.Каратыгин (1981) отмечал, что созревшие телиоспоры способны прорастать и вызывать новое заражение, но считал, что в условиях большей части территории бывшего СССР значение этой вторичной инфекции невелико. Таким образом, в зависимости от времени и способа проникновения гриба (внедрения инфекционной гифы, введения телиоспор, споридий при инокуляции, контаминации при повреждениях тканей кукурузы) латентный период может длиться от 7 до 70 дней. В этой связи следует процитировать предположение Ф.Е. Немлиенко (1957) о том, что при искусственном заражении «гриб на растении способен пройти за вегетацию до 3-4 пассажей», которое нередко воспринималось как аксиома, особенно представителями торгующих пестицидами фирм, рекомендующих проводить обработки от головни в период цветения кукурузы (см. табл. 1). Устойчивость кукурузы к U. maydis и принципы отбора.Природу устойчивости кукурузы к головне изучали фитопатологи, физиологи, биохимики, селекционеры и генетики. Наиболее ранняя классификация, предложенная М. Middendorf (1958), включала три формы устойчивости:
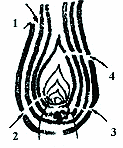
В дальнейшем Ф.Е. Немлиенко, И.Е. Сиденко (1969) объединили первую и вторую формы под именем “структурной” (“механической”) устойчивости, для третьей сохранили наименование физиологической устойчивости, предложив выявлять структурную устойчивость на естественных и провокационных фонах, а физиологическую – при искусственном введении телиоспор в ткани, способные заражаться. Кроме того, было предложено учитывать проявления возрастной и органотропной устойчивости (Салунская, 1962; Немлиенко, Кулик, 1962; Немлиенко, Сиденко, 1967; Гешеле, Иващенко, 1973). Эти методические подходы широко используются в селекционных учреждения России (и ранее в СССР). Сравнительное изучение нескольких предложенных ранее методов инокуляции (Чекалин, 1961; Немлиенко, Сиденко, 1967; Немлиенко и др., 1969) привело нас к заключению: 1) органотропные проявления устойчивости у линий коррелятивно не связаны; 2) 100% поражение початков, достигаемое у образцов, инокулированных на 2-3 день, и проявление различий на 7-й день после появления рылец (как предложено ВНИИ кукурузы, 1980) являются лишь свидетельством различного по продолжительности периода восприимчивости (Иващенко, 1992). Важно отметить, что пораженность початков достигает 100% у материала, прошедшего длительное изучение при негативном отборе. Показано, что инъекция в початок приводит к 4-7-кратному (Чернобай, 1986; Иващенко, 1992) увеличению пораженности, причем многими авторами отмечается преимущественное несовпадение показателей общей и физиологической устойчивости, то есть несравнимость данных, полученных на естественных и искусственных фонах. Работами второй половины ХХ века были расширены представления о биологии U. maydis, этиологии и патогенезе болезни, методических основах селекции на устойчивость и путях защиты от патогена (Stakman, Christensen, 1953; Немлиенко, 1957; Кузнецов, 1963; Christensen, 1963). Дальнейшими исследованиями биологии и генетической структуры популяций подтверждена нестабильность физиологических рас гриба, обусловленная сильной изменчивостью по морфологическим, культуральным признакам и патогенности (Stakman, Tyler, Hafstad et al., 1935; Кузнецов, 1963; Каратыгин, 1968, 1981; Юрку, Лазу, 1987). Установление гетерозиготности сортов по генам устойчивости (Garber, Quisenberry, 1925) и полигенной природы структурной и физиологической устойчивости (Immer, 1927; Munteanu et al., 1969; Bojanowski, 1969) было использовано для получения устойчивых линий при инбридинге сортов и популяций, а также для интеграции линий с устойчивостью разного типа в генотипе гибрида. С учетом этих особенностей биологии была признана нецелесообразной селекция на расоспецифический тип устойчивости, что позволило избежать в дальнейшем обесценивания исходного материала и обеспечило длительную устойчивость отобранных линий и гибридов к различным экологическим популяциям возбудителя (Расселл, 1982). Так, ряд американских линий кукурузы, устойчивых к U. maydis в США, проявили устойчивость и на юге Украины (Иващенко, 1977). Известно, что ограничивают заражение структурные (механические) преграды (плотное укрытие конуса нарастания листовой трубкой, плотное прилегание листовых влагалищ стебля, хорошее укрытие початка оберткой), тургорное состояние тканей, укороченность фазы восприимчивости отдельных органов, устойчивость к повреждению насекомыми, фитонцидность тканей и проявление активных физиологических реакций защитного характера. К этому перечню защитных особенностей следует добавить, что восприимчивы только молодые ткани, т.е. имеет место возрастная устойчивость. Показано (Гешеле, Иващенко, 1973), что генетику устойчивости, как сложного признака, необходимо изучать дифференцированно по проявлению каждого защитного механизма в отдельности. При этом информация о поражаемости кукурузы U. maydis(Jones, 1918; Immer, Christensen, 1931, 1942; Немлиенко, 1957; Чекалин, 1961; Немлиенко, Кулик, 1965; Vozdova, 1965; Рюмина, 1970 и др.), полученная на основе естественного поражения, характеризует действие многих факторов (в т. ч. неизвестной природы). При искусственном заражении початка или воронки листьев оцениваются роль и наследование лишь немногих защитных механизмов. II. Отношения в системе растение-хозяин – фитофаги – патогенОбщеизвестно, что нарушение вредителями целостности покровных тканей способствует проникновению грибов и бактерий. Связь фитофаг-возбудитель болезни может быть не только случайной, но и постоянной, как это имеет место при распространении вирусов. Через механические повреждения чаще проникают грибы, вызывающие корневые гнили, болезни увядания и т. д. Поэтому их часто называют раневыми паразитами. Считалось, что облигатные паразиты и факультативные сапротрофы проникают в растение преимущественно через покровную ткань и естественные ходы. Ряд авторов, отмечая зависимость развития болезни от множества факторов, относят к их числу шведских мух и кукурузного мотылька (Jenkins, 1929; Чернецкая,1932; Haenseller, Papper,1944; Christensen, Schneider, 1950; Павлов, Кожевникова, 1957; Koehler, 1959; Яковлева, 1963; Cусидко, Биенко, 1966; Рюмина, 1972; Бляндур, 1977), однако рассматривают поврежденность кукурузы насекомыми как временный и сопутствующий фактор, без учета типа повреждений, связи с онтогенезом и характером взаимоотношений вредителей и растения. Результаты исследований последних десятилетий показали, что “энтомологи и микологи стали неожиданно комплементарны; обнаружилось частичное перекрытие интересов в сфере научных поисков, возникла необходимость и перспективность междисциплинарных подходов” (Wheeler, Blackwell, 1984). Например, с наростами пузырчатой головни кукурузы и головни сорных просовидных злаков связан жизненнный цикл личинок Phalaerus politus, питающихся спорами гриба U. maydis (Boving, Graighead,1931). В дальнейших исследованиях установлена роль энтомофауны не только как вредителей, открывающих ворота инфекции для грибной и бактериальной флоры, но и как переносчиков болезней кукурузы: корневых и стеблевых нематод – в развитии корневых и стеблевых гнилей и карликовой мозаики (Palmer, 1969; Смилякович и др., 1975; Goswami, Raychaudhuri, 1978); шведских мух – пузырчатой головни (Павлов, 1956; Немлиенко,1957; Шапиро,1961); кукурузного мотылька – пузырчатой головни, стеблевых гнилей, болезней початков (Christensen et al., 1950; Koehler, 1950); листоедов (Diabrotica virgifera, D. longicornis) – корневых гнилей и фузариоза початков (Palmer, Kommedahl, 1969; Gilbertson et al., 1986). В свою очередь вирус карликовой мозаики увеличивает предрасположенность проростков к гиббереллезной и гельминтоспориозной корневым гнилям (Tu, Ford, 1971), а взрослых растений – к пузырчатой головне (Ivanovic, 1978). Первые патогенные ассоциации – между возбудителем графиоза ильмовых и жуком-короедом, обнаруженные в Европе (Spierenberg, 1922), и между шерстистой тлей и возбудителем рака яблони в США (Leach, 1940, цит. по: Anderson et al., 1984) – позволили переосмыслить не только этиологию болезней, но и их контроль. В дальнейшем многие отечественные и зарубежные исследователи отмечали увеличение распространенности пузырчатой головни в годы с высокой численностью шведских мух (Павлов, 1955; Немлиенко, 1957; Пан Сюн-Фэй, 1959; Шапиро, 1961; Федин, 1962; Павлов, Кожевникова, 1964; Шкурпела, 1965; Югенхеймер, 1979 и др.), рассматривая раневые инфекции как дополнительный фактор, как следствие преодоления личинками шведских мух ростового барьера, создаваемого нарастающими листьями. В этой связи целесообразно рассмотреть разработанную И.Д.Шапиро (1985) схему и особенности проникновения вредителя в растение. Как отмечает автор, “личинки шведской мухи адаптированы к обитанию внутри растения и используют в пищу меристемы. После отрождения они сразу же перемещаются к конусу нарастания, преодолевая при этом барьер из еще не сформировавшихся листьев, плотно облегающих апекс. Наиболее резко проявляется значение ростового барьера у кукурузы. Причина этому – продолжительный рост верхних листьев, окружающих конус нарастания. Так, например, темпы роста 4-го листа у сорта Одесская 10 и среднеранних Мандорфер и Воронежская 80 близки и достигают 1.05-1.10 мм/ч, а у раннеспелого сорта Белоярое пшено – 0.5 мм/ч. У сорта Воронежская 80, наиболее устойчивого к шведским мухам, личинки должны проникнуть к конусу нарастания через 14 слоев листьев по длинному пути и через 10 – по короткому пути (рис. 1). Лишь немногим личинкам, развившимся на кукурузе, удается переместиться к конусу нарастания и остановить рост 1 и 2 листа”.
Важно отметить, что проникновение личинок шведских мух и инфекционного начала головни к меристемным тканям кукурузы – это общая генетически предопределенная потребность в питании тканями, богатыми белком и углеводами, условие их успешного роста и развития. Рассматриваемый нами путь проникновения телиоспор или споридий в отсутствие раневых каналов (рис. 1, путь 1), вероятно, редко успешен, учитывая невысокую скорость колонизации тканей листьев грибом и быстрый вынос (12-25 мм/сутки) зон повреждения (и инфицированных зон) на периферию листовой воронки. Проведенная нами оценка устойчивости 101 гибрида кукурузы к шведской мухе показала, что при степени поражения растений от 10 до 56% (в среднем 26.6%) проявляется слабая отрицательная зависимость (r = -0.25, P‹0.05) между показателями интенсивности повреждения и степенью повреждения растений. При поврежденности гибридов 26.6% в среднем, степень их поражения пузырчатой головней составила 2.26%, что подтверждает данные И.Д. Шапиро (1985) о том, что “лишь немногим личинкам, развившимся на кукурузе, удается переместиться к конусу нарастания и остановить рост 1 и 2 листа”, а также наше предположение о низкой вероятности успешного заражения грибом в отсутствие повреждений шведской мухой. Результаты последовательной оценки повреждаемости 101 гибрида шведской мухой и кукурузным мотыльком приведены в таблице 3. Таблица 3. Динамика проявления и локализация галлов U. maydis в онтогенезе кукурузы в условиях естественного инвазионного и инфекционного фонов
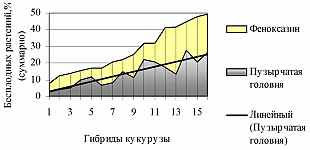
Примечание. Этапы органогенеза: IV-VII – листовая воронка; VIII – выдвижение метелок; IX – цветение; X – молочная спелость; XII – полная спелость зерна. ШМ – шведская муха;, КМ 1 и КМ 2 – кукурузный мотылек первого и второго поколения в сезоне соответственно. Как видно из данных таблицы 3, проявление головни у поврежденных шведской мухой растений начинается в фазе ранней листовой воронки и завершается к началу выдвижения метелок. В период выдвижения метелок начинается проявление головни на растениях, поврежденных преимущественно первым поколением кукурузного мотылька, а с периода цветения до созревания – вторым поколением. Повреждения хлопковой совкой приводят к развитию головни на початках в молочную – полную спелость зерна. Последовательность и растянутость лета указанных вредителей и нанесения растениям повреждений определяют и продолжительный период проявления головни, вследствие чего создается впечатление развития нескольких поколений U. maydis. Проведенные нами многолетние исследования (350 линий и гибридов, 1985-1988 гг.) выявили высоко достоверную связь развития пузырчатой головни и болезней початков с повреждением кукурузным мотыльком в зоне с одним поколением вредителя (лесостепь Украины) и с двумя (Краснодарский край). В Черкасской области эти корреляции составили 0,73 – 0,98 по пузырчатой головне и 0,79 – 0,94 по фузариозу початков в 1985-1988 гг., то в Краснодарском крае – 0,89 – 0,91 за аналогичный период (Иващенко, 1992; Иващенко и др., 2000). Наличие буровой муки и видимых повреждений облегчают установление взаимосвязи повреждение кукурузным мотыльком – поражение головней, поскольку очаг болезни преимущественно локален. При дистанционном поверхностном осмотре установление такой связи затруднено вследствие обширного патологического перерождения тканей (початок поражен полностью или частично), но и в этом случае остаются следы повреждения ножки початка, его стержня или оберток, стебля, метелки. Установить такую связь при повреждении кукурузы хлопковой совкой легче вследствие более крупных зон повреждения. Включение U. maydis в систему тритрофа (кукуруза-фитофаг-энтомофаг) неправомерно, так как возбудитель не имеет консортных взаимоотношений с кукурузным мотыльком и хлопковой совкой. Однако, создание раневых поверхностей (имеющее ежегодный устойчивый характер) служит своеобразным эдификаторам средообразующих условий, облегчающих колонизацию грибом восприимчивых меристем. Тесная и ежегодно проявляющаяся сопряженность ставит этиологию пузырчатой головни, её диагностику и контроль на вполне реальную почву, где в качестве одного из ведущих факторов выступает вредитель, в качестве регулятора его численности – энтомофаги (Trichogramma evanescens, Habrobracon hebetor и др.), паразитирование которых совместно с устойчивостью кукурузы к кукурузному мотыльку в значительной степени сдерживают численность популяций основных вредителей. При этом расчет поражаемости (в том числе в связи с повреждаемостью) осуществлялся по данным изучения полевой устойчивости при сохраненной структурной целостности растений (до контакта с фитофагами) в объеме и во времени, характерных для зоны, года изучения и сопряженности фаз онтогенеза растений и развития вредящей стадии насекомого. Полученные нами статистически достоверные данные в значительной мере могут изменить подходы к ограничению вредоносности болезней. Отмечается (Christensen, 1963), что условия, способствующие становлению паразитических взаимоотношений гриба и растения-хозяина, имеют большее значение в возникновении болезни, чем ингибирование или стимуляция уже внедрившегося гриба. Одним из таких условий является, по нашим данным, нарушение регламента применения гербицидов, приводящее к патологиям развития растений. Показателен в этой связи опыт селекционеров НПО «Элита» (Черкасская область Украины), где запоздалая обработка сортоиспытания гибридов гербицидом феноксазин (9 кг/га) привела к массовому развитию "саблевидности", при которой повреждение растений кукурузным мотыльком способствовало резкому увеличению пораженности пузырчатой головней и бесплодию растений, достигших суммарно 50% (в том числе 26.5% от пузырчатой головни) (рис. 2). Высокая и достоверная коррелятивная зависимость этих показателей (r = 0.878, P‹0.001) позволяет судить о вторичности патологического бесплодия, обусловленного патологией физиологической природы и инфицированием U. maydis, что привело к большей (в 19-23 раза) пораженности гибридов, чем в отсутствие гербицида. Районированные гибриды П 3969, Нордика, Коллективный 244 МВ (будучи более устойчивыми к кукурузному мотыльку) проявили наибольшую устойчивость и к бесплодию и головне соответственно.
Одним из отрицательных следствий борьбы с сорняками мог быть рост поражаемости пузырчатой головней при использовании атразина и лассо/атразина (Дудка и др., 1988). Более сильное поражение растений кукурузы пузырчатой головней на гербицидном фоне, чем на удобренном, отмечалось на юго-востоке центрального Черноземья (Лаптиёв, 2008). Заслуживает внимания и опыт защиты растений во Франции (Cabanettes, 1986), где пузырчатая головня достигала угрожающего распространения при использовании ряда пестицидных смесей. Инфицированию растений U. maydis способствует и обрывание метелок на участках гибридизации, в результате чего пораженность растений материнской формы возрастает в среднем в полтора раза, достигая у восприимчивых линий 20% (Иващенко, 1983). Такое устранение структурной устойчивости приводит к большему проявлению физиологической. Так были выявлены нами линия V 312 с устойчивостью физиологического типа (размер головневого вздутия у которой не превышает 2-3 см), а также линии со структурной и физиологической устойчивостью одновременно (А632, В37). По мнению Р.У. Югенхеймера (1979), обрывание метелок на участках гибридизации, отсутствие опыления початков и повреждение растений градом – основные причины, обусловливающие увеличение пораженности U. maydis. В качестве основной причины, объясняющей увеличение пораженности головней неопыленных початков, необходимо указать объедание рылец початков гусеницами хлопковой совки, что приводит к удлинению периода восприимчивости их эмбриональных меристем. Наши исследования роли заспорения семян телиоспорами U. maydis (Сотченко и др., 2008) подтвердили ранее накопленный опыт защиты растений и привели к заключению о нецелесообразности поиска и использования специальных протравителей для защиты от пузырчатой головни, поскольку семенами болезнь не передается и не поражает подземные органы (корни и мезокотиль), хотя проникновение гриба в корни экспериментально доказано (Sabbagh et al., 2006). ЗаключениеСложность природы полевой устойчивости к болезни, трудности создания универсальных инфекционных фонов и необходимость многолетнего изучения селекционного материала в различных экологических условиях привели выводу о разделении полевой устойчивости к возбудителю пузырчатой головни на структурную и физиологическую. Методы искусственного заражения кукурузы U. maydis неоправданно широко распространились в системе НИИ и Государственного сортоиспытания благодаря возможности получать с их помощью высокий уровень пораженности стеблей и початков, практически не наблюдаемый в природе, поскольку негативный отбор позволяет выбраковать восприимчивые формы в процессе селекции исходного материала и многолетних испытаний. Устранение при скрининге структурной устойчивости початков, даже при введении суспензии U. maydis в зону над метелкой и початком без их травмирования, привело к выявлению образцов с физиологической устойчивостью (с минимальным размером галлов). При этом различия в распространенности болезни, обусловленные продолжительностью периода восприимчивости, стали редко адекватны природным, связанным со спецификой повреждения растений комплексом вредителей. Ускользала от внимания исследователей избирательность как тип устойчивости растений к насекомым, её влияние на репродуктивный потенциал вредителей, учитываемые при отборе на групповую устойчивость к вредным организмам. Безусловно, технологические преимущества в воссоздании эпифитотийного уровня развития болезни при искусственной инокуляции очевидны, но в жертву технологичности приносятся особенности и степень выраженности структурного иммунитета, которые при искусственной инокуляции нивелируются, сужая возможности отбора. И одна из важных задач исследований состоит в использовании этого природного фона первичной дифференциации (осуществляемой фитофагами) для выявления наименее повреждаемых и поражаемых селекционных образцов. Многолетние исследования и анализ литературы привели нас к заключению, что, в отличие от патосистем многих облигатных паразитов, патосистема Zea mays — Ustilago maydis характеризуется рядом следующих биологических особенностей:
В серии публикаций (Иващенко, 1992, 2003; Иващенко и др., 2008; Иващенко, 2009, 2010) нами показано, что паразитоценоз кукурузы формируется в тесной связи с комплексом вредящих фаз фитофагов (шведская муха, кукурузный мотылек, хлопковая совка), первоначально создающих условия для внедрения грибной инфекции и колонизации ими меристем, что обусловлено эволюционно сложившейся общностью пищевых предпочтений группы фитофагов и U. maydis (тропностью), онтогенетической сопряженностью развития фитофагов и растений, что облегчает, надо полагать, реализацию агрессивности возбудителя болезни. В отличие от имеющих место стохастических связей (например, Oscinella frit — Sorosporium. reilianum), возбудителя пузырчатой головни и кукурузного мотылька характеризует стабильность консортивных межпопуляционных связей, их весьма положительная сопряженность (по Уранову, 1935) или зависимость (по Василевич, 1972), при которой увеличение численности фитофага вызывает увеличение численности патогена, что служит основанием для уточнения расчетов суммарной вредоносности фитофагов и патогенов, установления её пороговых значений, разработки прогноза распространения болезней. Кроме того, рассмотрение паразитоценоза кукурузы на уровне тритрофа в большей мере раскрывает возможности использования энтомофагов (трихограмма, габробракон и др.), их роль в снижении численности популяций не только фитофагов, но также распространения пузырчатой головни. Нам представляется (Воронин и др., 1999), что необходима и реальна дальнейшая интеграция иммунитета растений и биометода как биоценологической основы стратегии совершенствования фитосанитарных технологий в агроэкосистемах, призванной обеспечить оптимально-устойчивый биоценотически саморегулирующийся фитосанитарный режим. При характеристике входящего в паразитоценоз облигатного патогена U. maydis необходимо отметить функционирование с его участием двух типов патосистемы: локально-раневой (в терминологии автора) и множественно-локальной (по Davis,1936). Локально-раневая патосистема – следствие сопряженного развития видов, когда в результате питания фитофагов (онтогенетически приуроченного к питанию апикальной, интеркалярной и эмбриональной меристемами) облегчается проникновение, реализация агрессивности и завершение цикла развития облигатного паразита U. maydis. Она функционирует одновременно с патосистемой растение-хозяин – патоген, но важной характеристикой последней является множественность очагов распространения мицелия по направлению к меристематическим тканям, но на незначительное расстояние, частой локализацией грибницы в пазушных почках без видимых проявлений болезни. Такой характер распределения мицелия U. maydis по растению известен как множественно-локальный; локально-раневая патосистема, характеризующаяся проявлением галлов, учитывается при мониторинге распространения головни и олицетворяет объем успешных заражений растений определенного генотипа в природе, который намного меньше числа очагов множественно-локальной (скрытой) инфекции. Описанные выше особенности отношений в системе растение-хозяин – фитофаги – патоген характеризуют моноциклический тип болезни, эпифитотийных проявлений которой не отмечено. Семенами возбудитель не передается, их заспорение телиоспорами не приводит к возникновению болезни (в противоположность пыльной головне). Протравливание семян защищает проростки от широкого круга патогенов, в том числе от переноса телиоспор U. maydis в новые регионы. Включение в последние годы в системы защиты посевов зерновой кукурузы фунгицидов с целью снижения поражённости пузырчатой головней початков носит скорее превентивный характер, не связанный с прогнозируемым и экономически просчитанным недобором урожая. Такие обработки вероятно целесообразны в перечне приемов защиты сахарной кукурузы при прогнозируемо высокой численности вредителей початков, где недобор урожая от вредителей и головни выше, чем на обычной кукурузе. Приводимые в научной, учебной научно-популярной и специальной литературе последнего десятилетия рекомендации (подобные тем, что процитированы в таблице 1) сформулированы на основе недостаточно четких представлений об этиологии болезни и её патогенезе. Сопряженная патосистема (Zea mays — вредители (шведская муха, кукурузный мотылек, хлопковая совка) — U. maydis) является коэволюционно сложившейся, и в таком её значении дополняет базовую парадигму применительно к практической селекции на групповую и комплексную устойчивость к вредным организмам, её анализ позволяет оптимизировать разработку экологизированной системы защиты растений от фитофагов и патогенов. Она характеризуется проявлением у кукурузы эволюционно стабильной нерасоспецифической устойчивости, сохранение которой обеспечено правильно выбранной в начале ХХ века стратегией отбора. Сохранение этой устойчивости предполагает более широкий мониторинг раневых повреждений как показателя первичного выбора определенного генотипа растений (осуществляемого фитофагами), как природного фона, на котором облегчается выявление наименее повреждаемых и поражаемых селекционных образцов, как прогнозируемого и в значительной мере управляемого фактора в биологизации системы защиты кукурузы. ЛитератураАзбукина З.М. О грибных и бактериальных болезнях кукурузы в Приморском крае. // Труды Приморского СХИ, 1962, 1, с.71-74. Борггардт А.И. Современное состояние вопросов в области познания болезней кукурузы. // Избранные труды по фитопатологии. М., 1961, с.136-148. Борисенко С.И. Биологические особенности пузырчатой головни кукурузы. // Сб. научн. тр. 1951-1953 гг. Харьков,1954, с.141-149. Вилкова Н.А., Иващенко В.Г., Фролов А.Н. и др. // Методические рекомендации по оценке кукурузы на комплексную устойчивость к вредителям и болезням. М., ВАСХНИЛ, 1989, 43 с. Войтович К.А. Оценка пораженности пузырчатой головней селекционных материалов и гибридов кукурузы.// Труды Молдавской станции ВИЗР (1956-1958 гг.), 1958, 3 с. Воронин К.Е., Вилкова Н.А, Афанасенко О.С., Иващенко В.Г., Исси И.В., Воронина Э.Г. Интеграция иммунитета растений и биометода как биоценологическая основа стратегии совершенствования фитосанитарных технологий в агроэкосистемах. // Вестник защиты растений, СПБ, 1999, 1, с. 67-73. Гешеле Э.Э., Иващенко В.Г. Оценка кукурузы в процессе селекции на устойчивость к инфекционным заболеваниям. // Сб. научных трудов ВСГИ, Одесса, 1973, с. 211-225. Иващенко В.Г. Результаты изучения устойчивых к пузырчатой головне форм на участках гибридизации. //Селекция и семеноводство, 1983, 11, с.20. Иващенко В.Г., Флоря М.Б., Никоноренков В.А., Инглик П.В., Хроменко А.С. Исследование устойчивости кукурузы к различным экологическим популяциям возбудителей стеблевых гнилей и пузырчатой головни. // Труды II Национального симпозиума по иммунитету растений, Пловдив, 1983, 1, с. 243-249. Иващенко В.Г. Грибные болезни стеблей и листьев кукурузы в различных эколого-географических зонах. // Микология и фитопатология, 1991, 25, 5, с. 432-437. Иващенко В.Г. Болезни початков кукурузы. // Защита растений, 1991, 2, с.18-20. Иващенко В.Г. Устойчивость кукурузы к основным болезням и разработка методов ее повышения. // Автореф. докт. дисс. СПб., 1992, 38 с. Иващенко В.Г. Вредоносность основных болезней и кукурузного мотылька и возможности её уменьшения. // Кукуруза и сорго. 1996, 3, с.12-15. Иващенко В.Г. Типы устойчивости кукурузы к болезням и пути их использования в селекционной практике.//Матер. науч. семинара “Типы устойчивости растений к болезням”, СПб., ВИЗР, 2003, с.61-82. Иващенко В.Г. Распространенность основных болезней кукурузы в России и СНГ. // Вестник защиты растений (Приложение), СПб, 2007, с.68-81. Иващенко В.Г., Фролов А.Н., Сотченко В.С., Гаркушка В.Г. Селекция кукурузы на устойчивость к вредным организмам на современном этапе сельскохозяйственного производства России. // Вестник защиты растений, 2000, 2, с. 20-25. Иващенко В.Г., Сотченко Е.Ф. Фузариоз початков кукурузы в Ставропольском крае: этиология болезни, сортоустойчивость. //Матер. науч.-практ. конф. “Селекция, семеноводство, производство зерна кукурузы, 2002” Пятигорск, с. 157-164. Иващенко В.Г., Фролов А.Н., Дубровина А.Г., Гаркушка В.Г. Устойчивость кукурузы к вредным организмам как важнейший резерв реализации высокого потенциала продуктивности в селекции на гетерозис. //Докл. IV Международного Конгресса “Зерно и Хлеб России”, 11-13 ноября 2008 г., Санкт-Петербург, 2008, с.46-48. Калашников К.Я., Шапиро И.Д. Вредители и болезни кукурузы. М.-Л., Сельхозгиз, 1962, 189 с. Каратыгин И.В. Головневые грибы: онтогенез и филогенез. Л., 1981, 202 с. Каратыгин И.В. Строение патогена и его развитие в тканях растений-хозяев как критерий устойчивости растений к грибной инфекции. // Микология и фитопатология, 1968, 2, 5, с.414-420. Каратыгин И.В. Формирование сорусов и дифференциация спор Ustilago maydis (DC.) Cda. на листьях. //Докл. АН СССР, 1968, 183, 6, с.1458-1460. Каратыгин И.В. Генетическая характеристика цикла развития Ustilago maydis (DC.) Cda. // Микология и фитопатология, 1969, 3, 4, с. 368-376. Каратыгин И.В. Развитие в тканях Zea mays L. возбудителя пузырчатой головни в связи с его жизненным циклом. // Автореф. канд. дисс., Л., 1971, 25 с. Каратыгин И.В. Генетика головневых грибов.//Генетические основы устойчивости растений к болезням. Л., Колос, 1977, с. 95-109. Ключко П.Ф., Иващенко В.Г., Сергеев В.В. Использование метода сестринских скрещиваний в селекции кукурузы на устойчивость к пузырчатой головне. // Научно-техн. бюлл. ВСГИ, Одесса, 1976, 27, с.10-13. Кобелева Э.Н., Бляндур О.В. Селекция мутантных линий кукурузы на болезнеустойчивость. Кишинев, 1977, с.67. Кузнецов Л.В. О жизнеспособности гриба Ustilago zeae (Beckm)Ung. – возбудителя пузырчатой головни кукурузы. // Вестн. Моск. гос. ун-та, VI, Биол. и почв., 1963, 2, с.30-39. Кулик.Т.А. Влияние экологических факторов на поражаемость кукурузы пузырчатой головней (Ustilago maydis (DC.) Cda.). // Микология и фитопатология, 1968, 2, 5, с.428-432. Лаптиев А.Б. Биоэкологическое обоснование фитосанитарной оптимизации агроэкосистем юго-востока центрального Черноземья. //Автореф. докт. дис. Санкт-Петербург, 2008, 39 с. Левада С.А. Повышение эффективности защитных мероприятий против болезней кукурузы на орошаемых участках степи УССР. // Автореф. канд дисс. Днепропетровск, 1990, 22 с. Мещерякова Р.И. Повышение устойчивости кукурузы к пузырчатой головне. // Автореф. канд. дисс. Харьков, 1959. Мусийко А.С., Гешеле Э.Э., Вальтер О.Ю. О некоторых вопросах биологии возбудителя пузырчатой головни кукурузы. //Агробиология, 1969, с.579-582. Немлиенко Ф.Е. Болезни кукурузы. Сельхозгиз, 1957, 230 с. Немлиенко Ф.Е., Кулик Т.А. Органотропная устойчивость кукурузы к пузырчатой головне. // Кукуруза, 1962, 4, с.57-59. Немлиенко Ф.Е., Сиденко И.Е. Онтогенетическая устойчивость кукурузы к пузырчатой головне. // Докл. ВАСХНИЛ, 1967, 1, с.7-9. Немлиенко Ф.Е., Грисенко Г.В., Кулик Т.А., Сиденко И.Е. Об иммунитете кукурузы к пузырчатой головне и стеблевой гнили. // Бюлл. ВНИИ кукурузы. Днепропетровск, 1969, 1(3), с.49-54. Немлиенко Ф.Е., Сиденко И.Е. О механическом и физиологическом иммунитете кукурузы к пузырчатой головне. // Труды Харьковского с.-х. ин-та, 1969, 79, с.67-72. Немлиенко Ф.Е. К методике учета пораженности кукурузы пузырчатой головней // Селекция и семеноводство, 1949, 4, с.68-70. Немлиенко Ф.Е. Степень изученности и практического использования иммунитета кукурузы к болезням. // Тез. III Всесоюзн. совещ. по иммунитету растений. Кишинев, 1959, с.3-8. Немлиенко Ф.Е., Кулик Т.А. Органотропная устойчивость кукурузы к пузырчатой головне. // Кукуруза, 1962, 4, с.57-59. Немлиенко Ф.Е., Кулик Т.А. Использование устойчивости кукурузы к пузырчатой головне в селекционной работе. // Тез. докл. IV Всес. совещ. по иммунитету с.х. растений. Кишинев, 1965, с.181-182. Немлиенко Ф.Е., Сиденко И.Е. Онтогенетическая устойчивость кукурузы к пузырчатой головне. // Докл. ВАСХНИЛ, 1967, 12, с.7-9. Павлов И.Ф. Способы борьбы со шведской мухой и другими вредителями кукурузы. // В кн.: Кукуруза в 1955 г., Сельхозгиз, 1956, 2, с. 124-127. Павлов И.Ф., Кожевникова Л.И. Защита растений от вредителей и болезней. В кн.: Пропашная система земледелия. М., 1964, с.107-120. Пан Сюн-Фэй. Шведская муха и пузырчатая головня на кукурузе. // Защита растений от вредителей и болезней, 1959, 2, с.25. Пиковский М., Кирик Н., Вердыш А.. Болезни семян кукурузы.// Овощеводство (Украинский журнал для профессионалов), 2010, 12. с.64-67. Расселл Г.Э. Селекция растений на устойчивость к вредителям и болезням. М., Колос, 1982, 421 с. Рюмина М.А. Устойчивость кукурузы к пузырчатой головне и разработка методов ее повышения. // Автореф. канд. дисс., Л., 1970, 23 с. Рюмина М.А. Оценка устойчивости самоопыленных линий кукурузы к пузырчатой головне. // Тр. по прикладной ботанике, генетике и селекции. Л., 1972, 46, 3, с.91-97. Салунская Н.И. Какие органы кукурузы поражаются пузырчатой головней. // Ботанический журнал, 1964, 49, 7-12, с. 1034-1035. Салунская H.I. Минливiсть популяцiй гриба Ustilago zeae (Beckm.) Ung. – збудника пухирчастой сажки кукурудзи. // Захист рослин, 1969, 7, с.41-51. Слепян Э.О., Каратыгин И.В. Продуктивно-некротическая эритродермия – первичный симптом инфекции Ustilago maydis (DC..) Cda. на листьях. // Докл. АН СССР, 1968, 178, 5, с.1212-1215. Слепян Э.И., Каратыгин И.В. Порядок головневые (Ustilaginales). // Жизнь растений, 1976, 2, с.346-353. Сотченко Е.Ф., Сотченко Ю.В., Иващенко В.Г., Алексеева О.В. Эффективность Витавакса 200 ФФ против пыльной и пузырчатой головни кукурузы. // Защита и карантин растений, 2008, 2, с.27-28. Сусидко П.И. Биенко М.Д. Шведская муха в южных районах и меры борьбы с ней. // Кукуруза, 1966, 10, с.19. Тихонов Н.А., Тихонов С.П. Пузырчатая головня кукурузы в Крыму. // Тр. Крымской гос. c.-х. опытной станции, 1969, 5, c.29-38. Ульянищев В.И. Микрофлора Азербайджана, Т.1. Головневые грибы. Баку, 1952, 334 c. Уранов А.А., 1935 (цит. по: Василевич В.И. Количественные методы изучения структуры растительности: Итоги науки и техники, В кн.: Ботаника, М., ВИНИТИ, 1972,1, с.7-83. Федин М.А. Поражаемость кукурузы шведской мухой и пузырчатой головней в зависимости от сроков сева. // Защита растений от вредителей и болезней, 1962, 5, с.29. Фролов А.Н., Малыш Ю.М. Плотность размещения и смертность яиц и младших гусениц кукурузного мотылька на растениях кукурузы // Вестник защиты растений, СПб ВИЗР, 2004, 1, с. 42-55. Чекалин Н.М. Оценка некоторых методов заражения пузырчатой головней // Труды аспирантов и молодых научных сотрудников ВИР, 1961, 2, с.112-116. Чернецкая З.Н. Болезни кукурузы. // Сводный отчет Горской зональной станции. Орджоникидзе, 1932, 22 с. Шапиро И.Д. Шведская муха, как вредитель кукурузы. В кн.: Распространение вредителей и болезней сельскохозяйственных культур в РСФСР в I960 г. и прогноз их появления в 1961 г., Л., 1961, с.54-62. Шапиро И.Д., Вилкова Н.А., Иващенко В.Г., Фролов А.Н. Иммунологические основы изучения сопряженных патосистем .// Тез. докл. Х научн. Конф. Украинского общества паразитологов, Одесса, 1986, с. 344. Шапиро И.Д. Иммунитет полевых культур к насекомым и клещам. Л., 1985, с.140-151. Шкурпела И. Шведская муха и пузырчатая головня. // Защита растений от вредителей и болезней, 1965, 5, с.59. Югенхеймер Р.У. Кукуруза и ее улучшение. М., Колос, 1979, 519 с. Юрку А.И., Лазу М.Н. Генетические аспекты устойчивости кукурузы к пузырчатой головне. Кишинев, 1987, с.177. Яковлева Н.П. Тканевая и возрастная специализация возбудителя пузырчатой головни. // Вестник с.-х. науки, 1963, 2, с.45-51. Agrios G. N. Transmission of plant diseases by insects. // Plant pathology (4th ed.). Academic Press, San Diego, California. Anonymous. Compendium of Diseases. 1997, р. 442-445. Barnes C.W., Szabo L.J., May G., Groth J.V. Inbreeding levels of two Ustilago maydis populations. // Mycologia, 2004, 96, p.1236-1244. Bojanowski J. Studies of inheritance of reaction to common smut in corn. // Theoret. and Appl. Genet., 1969, 39, 1, p. 32-42. Boving A.G., Graighead F.C. An illustrated synopsis of the principal дarval forms in the order Coleoptera. // Entomologia Americana, 1931, 1, 1, p.351. Brefeld О. Untersuchungen aus dem Gesammtgebiete der mykologie. XI. Die Brandpilze. II Die Brandkrankheiten des Getreides. Munster, 1895, 98 s. Christensen J., Schneider C. European corn borer in relation to shank, stalk and ear rots of corn. // Phytopathol., 1950, 40, 3, p.284-291. Christensen J.J. Cоrn smut caused by Ustilago maydis. // The Amer. Phytopath. Soc. Мonograph., 1963, 2. р.12-20. Christensen J.J., Stakman E.G. Physiologic specialization and mutation in Ustilago zeae. // Phytopathol., 1926, 16, 2, p. 979-999. Clinton G.R. Smuts of Illinois agricultural plants. // III Agr. Exp. Sta. Bul., 1900, 57, p. 289-360. Davis G.N. Corn latent and expressed. // Phytopath., 1936, 26, 1, p.91. Davis G.N. Some of the factors influencing the infection and pathogenicity of Ustilago zeae (Beckm.) Unger) on Zea mays L. // Iowa Agric. Exp. Sta. Res. Bul., 1936, 199, p.247-258. Doehlemann G., van der Linde K., Aßmann D., Schwammbach D., Hof A., et al. Pep1, a secreted effector protein of Ustilago zeae, is required for successful invasion of plant cells. // PLoS Pathog., 2009, 5(2): e1000290. doi:10.1371/journal.ppat.1000290. Dolinka B. Otpornost i tolerantnost kukuruza prema aved-skoj masci i kukuruznom plamenae v Nartonvasaru. // Savremen.Poljopr., 1969, 17 p. du Toit, L.J., and Pataky J.K. Effects of silk maturity and pollination on infection of silks to maize ears by U. maydis. //Plant Dis., 1999, 83, 7, p. 621-626. Dungan G.H. Woodworth C.M. Loss resulting from pulling leaves with tassels in detasseling corn. // Agron. J., 1939, 31, p.872-875. Garber R.J., Quisenberry K.S. Breeding corn for resistance to smut (Ustilago zeae). // J. Amer. Soc. Agron., 1925, 17, p.132-14. Gilbertson R.L., Manning W.J., Ferro D. F. Аssociation of the asparagus minor stem rot caused in asparagus by Fusarium species. // Phytopath., 1985, 75, 11, p.1188-1191. Grogan C. Detasceling responses in corn. // Agron. J., 1956, 48, 6, p.247-249. Наnna W.F. Studies in the physiology and cytology of Ustilago zeae and Sorosporium reilianum. // Phytopath., 1929, 15, 5, 415-441. Harris M, Frederiksen R. Concepts and methods regarding host plant resistance to arthropods and pathogens.// Ann. Rev. Phytopathol., 1984, 22, р, 247-272. Hitchcock A.S., Norton J.B.S. Corn smut. // Kans. Agr. Exp. Sta. Bul., 1896, 62, 169-212. Holiday R. Genetic of Ustilago maydis. // Genetic Res.,1961, 2, 2, p. 204-231. Hooker A.L. Inheritance of mature plant resistance to rust in corn. // Phytopathol., 1967, 57, p.815. Huttig W. Uber der temperatur auf die keimung und geschletsverteilung bei brandpilzen. // Z. Bot., 1931, 24, s.529-557. Immer F.R. Inheritance of reaction to Ustilago zeae in maize.// Agron. and Plant Genetics, 1927, 51, p.599-602. Immer F.R., Christensen J.J. Determination of loses due to smut interaction in selfed lines of corn. // Phytopathol., 1928, 18, p. 599-602. Immer F.R., Christensen J.J. Further studies on the relation of corn to smut and effect of smut on yield. // Phytopathol., 1931, 21, p. 621-674. Ivanovic M. Uticaj virusnog mozaika kukuruza na osetlivost gljivi kukuruza prema Ustilago maydis. D.C. Corda. // Zastita Bijya, 1979, 30, 148, s.135-140. Jenkins M.T. Correlation studies with inbred and crossbred strains of maize. // J. Agr. Res., 1929, 39, p.677-721. Jones D.F. Segregation of susceptibility to parasitism in maize. //Amer. Jour. Bot., 1918, 5, p. 295-300. Kahmann R. Establishment of compatibility in the Ustilago maydis. //Мaize pathosystem. J. Plant Physiol., 2008, 165, p.29-40. Koehler B. Corn ear rots in Illinios. // Ill. Agr. Exp. Sta. Bul., 1959, 69, 87 p. Kyle C. Relation of husk covering to smut of corn ears. // U.S. Dept. Agr. Techn. Bul., 1929, 120, p.1-7. Martinez-Espinoza A.D., Leon-Ramrez C.G., Ruiz-Herrera N.S.J. Use of PCR to detect infection of differentially susceptible maize cultivars using Ustilago maydis strains of variable virulence. // Published online: 24 May 2003, Springer-Verlag and SEM 2003. Middendorf M. Untersuchungen uber methoden sur infection mit mais brend (Ustilago zeae) und ichre aihangigheit von alter temperature und sorte. // Der Zuchter, 1958, 28, 2, s. 92-93. Mills L.I, Kotze I.M. Scanning electron microscopy of the germination growth and infection Ustilago maуdis on maize. // Phytopathol. Z., 1981, 102, 1, p. 21-27. Munteanu I., Cabulea I, Radulescu E. Studies in immunity and inheritance of corn response to Ustilago maydis (Dc.) Corda. // Savremena Poliopr., 1969, 17, 5-6, p. 407-415. Palmer L., Kommedahl T. Root infecting Fusarium species in relation to rootworm infestations in corn. // Phytopathol., 1969, 55, 11, p.1613-1617. Platz G.A. Some factors influencing the pathogenicity of Ustilago zeae. // Jowa State Coll. J. Sci., 1929, 3,. p.177-214. Rowell J.B., De Vay J.E. Genetics of Ustilago zeae in relation to basic problems of its pathogenicity. // Phytopath., 1954, 44, 4, p. 356-362. Sabbagh S.K., Martinez Y., Roux C. Root penetration of maize by Ustilago maydis. // Czech. J. Genet. Plant Breed., 2006, 42, p.79-83. Schmitt C.G. Cultural and genetics studies on Ustilago zeae. // Phytopath., 1940, 30, 5, p. 381-390. Scurti J. On the morbid histology of maize attaced by Ustilago maydis.// In: Annali Della sperimentazione agragia, niova serie, 1950, 4, 5, p. 827-855. Stakman E.C., Tyler L.J., Hastad.G.E. et al. Experiments on physiologic specialization and nature of variationig Ustilago zeae.// Phytopath., 1935, 25. Stakman E.G., Christensen J.J. Problems of variability in fungi. In: Plant Diseases. The Yearbook of Agriculture. U.S. Dept. of Agriculture, 1953, p.35-62. Tu L., Ford R. Maize dwarf mosaic virus predisposes corn to rot root infection. // Phytopath., 1971, 61, 7, p.800-803. Vǒzdóva G.M. Metodiké otazky hodnoceni kukurice na odolnost ke sneti kukuřice (Ustilago zeae (Beckm.) Unger). // Sbornik ved. praci Vuku, 1965, 1, s. 55-73. Walter J.M. Factors affecting the development of corn smut Ustilago zeae (Beckm.) Unger. // Minnesota Agric. Exp. Sta. Techn.Bul, 1935, 111, 65 p. Walter J.M. The mode of entrance of Ustilago zeae into corn plants. // Phytopathol., 1934, 24, p.1012-1020. Wheeler Q., Blackwell M. Fungus – insect relatioships. 1984, 514 p. Zambino P., Groth J.V., Lukens L., Garton J. R. May G. Variation at the b mating-type locus of Ustilago maydis. Phytopath., 1997, 87, р.1233-1239. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||